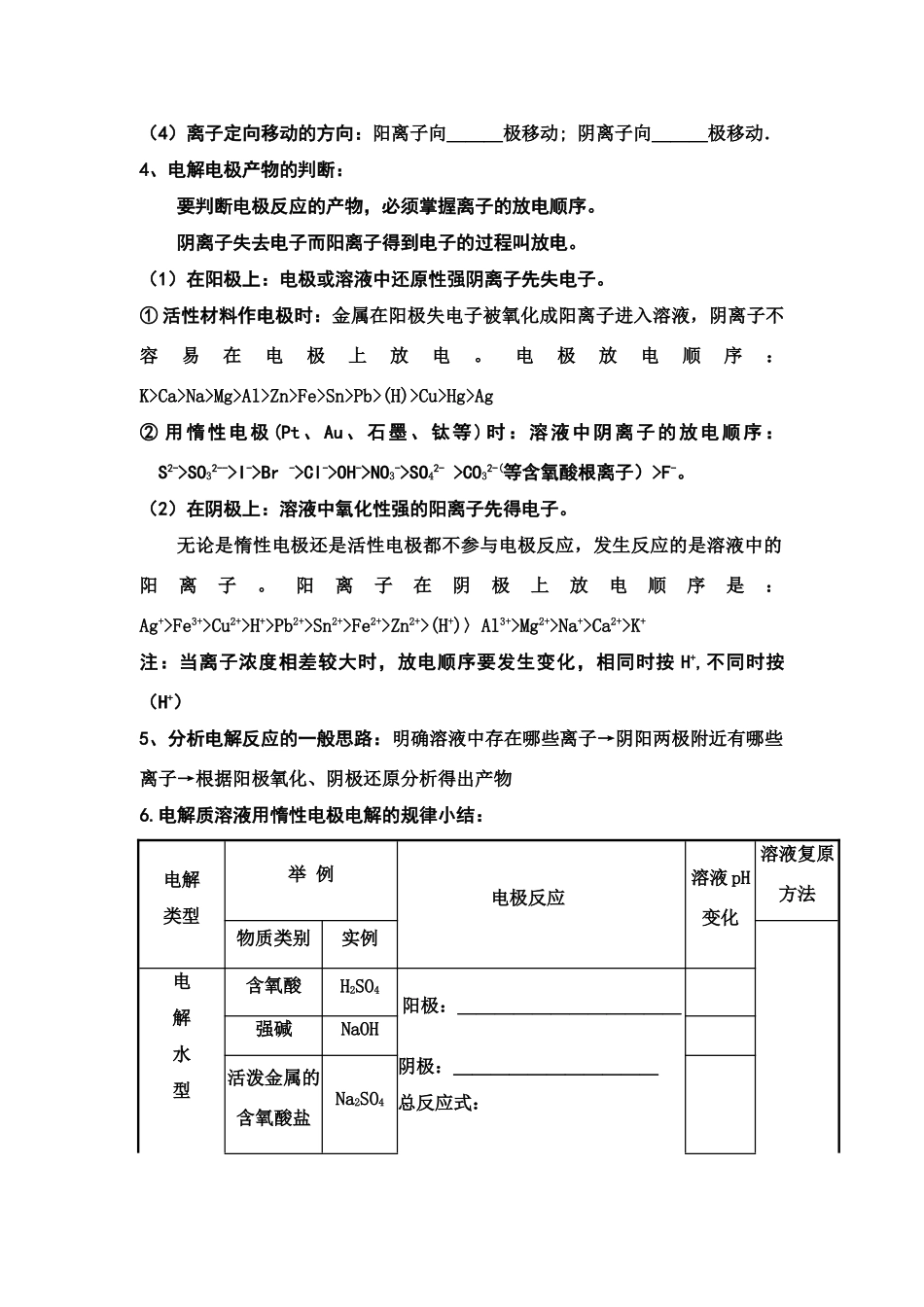
第一节:电解原理及其应用高考要求:1、理解电解原理、正确地判断阴极和阳极,正确地书写电极反应式。2、掌握离子的放电顺序。重难点:了解铜的电解精炼、镀铜、氯碱工业反应原理知识梳理:一、电解1、概念:使______通过电解质溶液而在阴阳两极发生________________的过程。2、电解的原理:电解质在溶于水或熔融状态下电离出能自由移动的离子;通电时,自由移动的离子作定向移动:阴离子移向_____极,在____极上_____电子而发生____反应;阳离子移向_____极,在_____极上_____电子而发生_______反应。3、电解池(电解槽):__________________________________________________.(1)构成条件:①_________________________________;②___________________________③____________________________;④____________________________。(2)电极名称与判断、电极反应:如电解CuCl2溶液阳极:与电源_____极相连的极;阳极发生_____反应电极式____________阴极:与电源____极相连的极;阴极发生_____反应电极式___________电解CuCl2溶液的总反应式为___________________(3)电子的流向:电子从外加电源的__极流出,流到电解池的__极,再从__极流回电源__极。(注:电子只在外电路定向移动,不能从溶液中移动)接电源正极的为______极,发生______反应;接电源负极的为_____极,发生_______反应;(4)离子定向移动的方向:阳离子向___极移动;阴离子向___极移动.4、电解电极产物的判断:要判断电极反应的产物,必须掌握离子的放电顺序。阴离子失去电子而阳离子得到电子的过程叫放电。(1)在阳极上:电极或溶液中还原性强阴离子先失电子。①活性材料作电极时:金属在阳极失电子被氧化成阳离子进入溶液,阴离子不容易在电极上放电。电极放电顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag②用惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序:S2->SO32-->I->Br->Cl->OH->NO3->SO42->CO32-(等含氧酸根离子)>F-。(2)在阴极上:溶液中氧化性强的阳离子先得电子。无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子在阴极上放电顺序是:Ag+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>(H+)〉Al3+>Mg2+>Na+>Ca2+>K+注:当离子浓度相差较大时,放电顺序要发生变化,相同时按H+,不同时按(H+)5、分析电解反应的一般思路:明确溶液中存在哪些离子→阴阳两极附近有哪些离子→根据阳极氧化、阴极还原分析得出产物6.电解质溶液用惰性电极电解的规律小结:电解类型举例电极反应溶液pH变化溶液复原方法物质类别实例电解水型含氧酸H2SO4阳极:____________阴极:___________总反应式:强碱NaOH活泼金属的含氧酸盐Na2SO4分解电解质型无氧酸HCl阳极:__________阴极:__________总反应式:不活泼金属的无氧酸盐CuCl2阳极:___________阴极:___________总反应式:放H2生碱型活泼金属的无氧酸盐NaCl阳极:____________阴极:____________总反应式:不活泼金属的含氧酸盐CuSO4阴极:___________阳极:___________总反应式:(1)电解规律(惰性电极)小结:S2->I->Br->Cl->OH->含氧酸根>F-ⅠⅡAg+>Fe3+>Cu2+>H+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+ⅢⅣ(3)歌诀:只放氢pH升(_____型);只放氧pH降(______型);放氢放氧浓度增;(_____型);无氢无氧少本身。(______型).要明确溶液中阴阳离子的放电顺序,有时还需兼顾到溶液的离子浓度。如果离子浓度相差十分悬殊的情况下,离子浓度大的有可能先放电。如理论上H+的放电能力大于Fe2+、Zn2+,但在电解浓度大的硫酸亚铁或硫酸锌溶液时,由于溶液[Fe2+]或[Zn2+]>>[H+],则先在阴极上放电的是Fe2+或Zn2+,因此,阴极上的主要产物则为Fe和Zn。但在水溶液中,Al3+、Mg2+、Na+等是不会在阴极上放电的。放O2生酸型(2)电解质溶液电解规律:Ⅰ与Ⅲ区:电解电解质型Ⅰ与Ⅳ区:放氢生碱型Ⅱ与Ⅲ区:放氧生酸型Ⅱ与Ⅳ区:电解水型(4)电解时溶液pH值的变化规律...