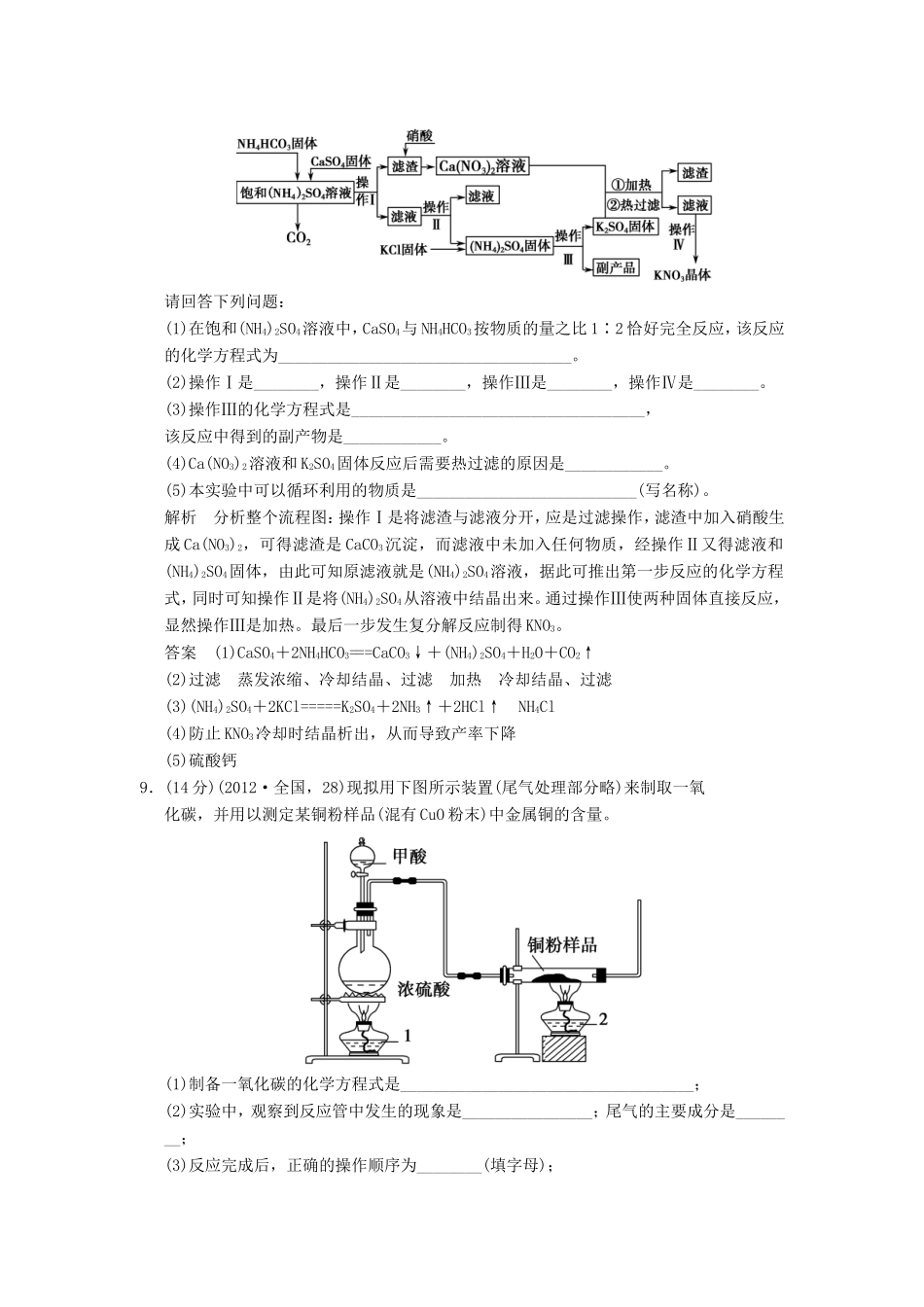
(时间:45分钟分值:100分)一、选择题(共7个小题,每小题6分,共42分,每小题给出的四个选项中只有一个是正确的)1.(2012·福州期末)浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是()。A.酸性B.脱水性C.强氧化性D.吸水性解析浓硫酸能使蔗糖炭化,并能闻到刺激性气味的气体,体现了浓硫酸的脱水性、强氧化性,因是含有水分的蔗糖,所以还体现了吸水性。答案A2.(2012·山东莱芜期末)下列说法不正确的是()。A.凡是铵盐均能与苛性钠共热产生氨气B.向铜粉中加入稀硫酸,铜粉不溶解,再加入Cu(NO3)2固体,铜粉溶解C.将二氧化硫通入溴水,溴水褪色后加热不能恢复原色D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高解析玻璃没有固定的熔点,属于玻璃态物质,只能在一定范围内软化,D项不正确。答案D3.(2012·合肥一模)下列有关化学反应过程或实验现象的结论中,正确的是()。A.NH3的水溶液可以导电,说明NH3是电解质B.在高温条件下,C能置换出SiO2中的Si,说明C的还原性强于SiC.在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液,溶液褪色,说明CaCl2溶液显酸性D.向淀粉碘化钾溶液中加入溴水,溶液变为蓝色,说明Br2的氧化性强于I2解析NH3与水反应生成的NH3·H2O能电离出自由移动的离子,而NH3属于非电解质;由反应2C+SiO2=====2CO↑+Si并不能得出C的还原性强于Si;D项中发生的反应为2KI+Br2===2KBr+I2,即Br2的氧化性强于I2。答案D4.(2012·皖北名校联考)对下列事实的解释正确的是()。A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性B.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于酸C.向50mL18mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45molD.常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应解析A项Cl2不具有漂白作用,而是其与水反应生成的HClO的强氧化性;C项因随着反应的进行,硫酸的浓度降低,稀硫酸不能与铜反应,不正确;D项因常温下浓硫酸使铝钝化(化学变化),形成致密的氧化膜阻碍了反应的继续进行。答案B5.(2012·合肥第一次质检)下列实验过程中,始终无明显现象的是()。A.NO2通入FeSO4溶液中B.CO2通入CaCl2溶液中C.NH3通入AgNO3溶液中D.SO2通入Ba(NO3)2溶液中解析A项溶液由浅绿色变为棕黄色,正确;B项因盐酸的酸性比碳酸的酸性强,故不会出现明显的现象;C项会先产生沉淀,NH3过量后沉淀溶解;D项会产生白色沉淀。答案B6.(2012·合肥第一次质检)二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(见下图)。下列说法正确的是()。A.SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物B.SiO2和Si都是光导纤维材料C.在硅胶中加入CoCl2可显示硅胶吸水是否失效D.图中所示转化反应都是非氧化还原反应解析两性氧化物的定义为与酸和碱反应均生成盐和水的氧化物,SiO2与HF反应得到的SiF4不属于盐类,A项错误;SiO2是光导纤维材料,Si为半导体材料,B项错误;CoCl2在吸水和失水状态下显示不同的颜色,C项正确;制取Si的过程中涉及了氧化还原反应,D项错误。答案C7.(2012·临沂期中,16)在某100mL混合酸中,HNO3物质的量浓度为4mol·L-1,H2SO4为2mol·L-1,向其中加入19.2g铜粉微热,待充分反应后,则被还原的HNO3物质的量为()。A.0.4molB.0.2molC.0.225molD.无法计算解析溶液中进行的反应实际上是稀硝酸和Cu的反应,在溶液中n(H+)=0.1L×(4mol·L-1+2×2mol·L-1)=0.8mol,n(NO)=0.1L×4mol·L-1=0.4mol,n(Cu)==0.3mol,溶液中发生的反应为:3Cu+8H++2NO===3Cu2++2NO↑+4H2O,故Cu能够将0.2mol的NO还原。答案B二、非选择题(共4个题,共58分)8.(14分)硝酸钾是一种重要的化工产品,工业上制备硝酸钾的流程如图所示:请回答下列问题:(1)在饱和(NH4)2SO4溶液中,CaSO4与NH4HCO3按物质的量之比1∶2恰好完全反应,该反应的化学方程式为____________________________________。(2)操作Ⅰ是________,操作Ⅱ是________,操作Ⅲ是________,操作Ⅳ是________。(3)操作Ⅲ的化学方程式是________________________________...