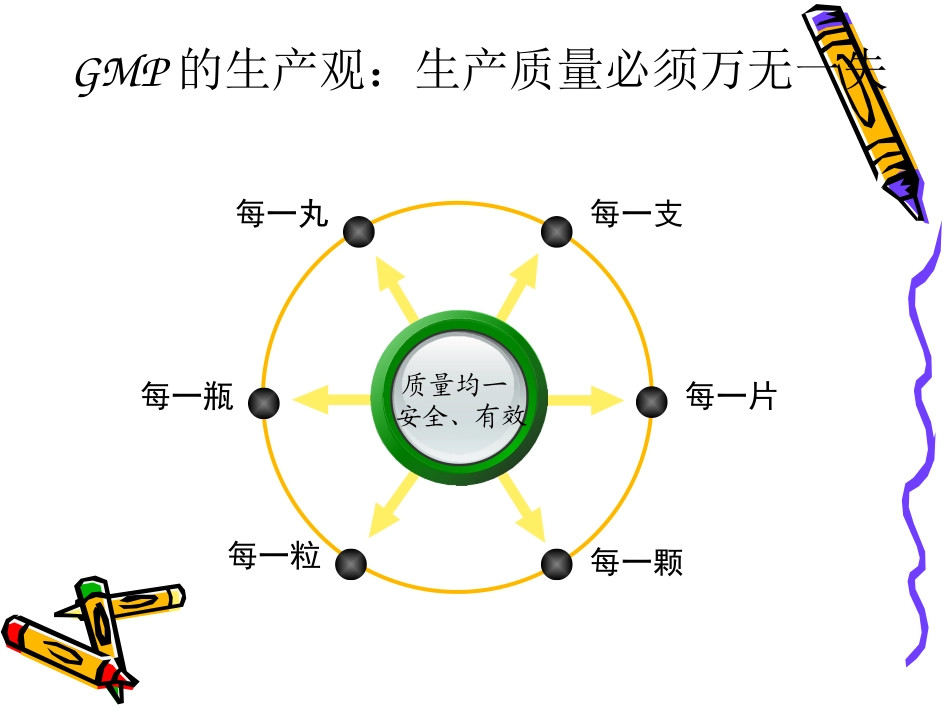
医药厂房与医药厂房与GMPGMP医药工业洁净厂房设计必须符合GMPGMP洁净厂房设计医药工业洁净厂房药品生产GMP的生产观:生产质量必须万无一失每一支每一丸每一片每一颗每一瓶每一粒质量均一安全、有效GMP的生产观:生产过程必须全程控制•传统生产观念----不让不合格品出厂•GMP生产观念----不生产不合格产品•传统控制观念----把好成品出厂关•GMP控制观念----生产全过程控制•传统控制方法----检验合格放行•GMP控制方法----参数合格放行参数放行特点•参数放行—强化生产过程微生物控制,用生产过程所涉及的设施、设备、仪器的运行参数控制来确保产品无菌。•验证参数放行—以工艺、设备、设施、仪器的有效验证为基础,比最终检验科学、安全、可靠。•实施情况—目前发达国家已普遍接受参数放行理念和实践;我国2005年起在部分企业试行。GMP的生产观:生产环境必须全面净化•环境决定产品药品生产环境包括:厂区周围环境厂内总体环境洁净室(区)环境与药品接触的场合和微环境全面净化范围厂房设施设备工器具空气水质原辅料半成品包装材料生产环境仓储生产检验监管操作检验管理维修生产人员生产操作生产物料生产设施GMP的生产观行标《医药洁规》新《医药洁规》国标洁规1985年发布2001年修订洁净厂房设计规范GB50073-20011997年发布医药工业洁净厂房设计规范2008年底发布2009年6月执行医药工业洁净厂房设计规范GB50457-2008医药洁净厂房设计质量源于设计QualitybyDesign新概念环境决定产品(1)质量源于设计(QbD)形成于美国半导体行业,2005年影响到制药行业,2006年在Pfizer、Merck、Lilly公司启动并取得经验,在一定工艺参数范围内,最大限度地保证了产品的质量。美国FDA鼓励企业实施QbD目前,我国由北大领头,在浙江、上海、北京等地制药企业试点,每年组织QbD国际研讨会。(1)质量源于设计(QbD)药品从最初的研发开始就要考虑最终产品的质量。药品在处方设计、工艺路线确定、工艺参数选择、物料控制及工程设计方案等方面都要将质量放在首位。在深入研究,积累翔实数据的基础上,确定最佳的产品处方,生产工艺和工程设计。质量源于设计槽型混合机高速制粒混合机由设备引起的污染制药设备中的常见病注射用水储罐设备水滞留设备水滞留单管循环方式由输水管道引起的污染注射用水储罐设备设备双管循环方式纯化水循环系统(并联)纯化水循环系统(并联)注射用水储罐设备设备串联方式纯化水循环系统(串联)纯化水循环系统(串联)洁净厂房设计的新概念•质量源于设计(QbD)产品质量是检验出来的由产品质量是生产出来的到产品质量是设计出来的再到•质量源于设计•环境决定产品药品生产需要良好的环境支撑良好的生产环境离不开设计对生产环境的污染控制,不能只局限于洁净室,应把控制范围延伸到与洁净室相关的各种相应环境上。只有洁净室及相关环境都处于受控状态,才能生产出始终如一的合格产品。洁净厂房设计的新概念《医药洁规》全程控制的设计思路•消除一切污染隐患和可能存在的风险,建立有效的污染控制动态保障体系,才能实现全程控制•对洁净室的污染控制,应延伸到可能造成洁净室污染隐患的各种相关环境上•只有洁净室及相关环境都处于受控状态,才能生产出万无一失的合格产品医药洁净厂房设计质量源于设计QualitybyDesign新概念环境决定产品GMP简介•GMP:GMP是药品的研究与开发(GLP、GCP)、生产过程(GMP)、经营与临床应用(GSP、GUP)的中心环节。•定义:药品生产质量管理规范。•GMP是为确保药品质量万无一失,对药品生产中影响质量的各种因素所规定地一系列基本要求。适用于药品制剂生产地全过程、原料药生产中影响成品质量地关键工序。实施GMP的意义:•1.能够保证各生产环节的规范性;•2.能够保证各生产环节的质量;•3.可以减少各操作的波动性和人为因素对产品质量的影响;•4.能对各生产环节、质量关键点进行验证。GMP的三大要素:•1.人员素质要素:指对全体人员(包括各级人员、工人和厂长)的管理;•2.物质要素:指对全部物质(包括生产用原辅料、包装材料、机器、厂房、器械)的管理;•3.管理要素:指对全过程(从原辅料的购买到生产再到售后服务)...