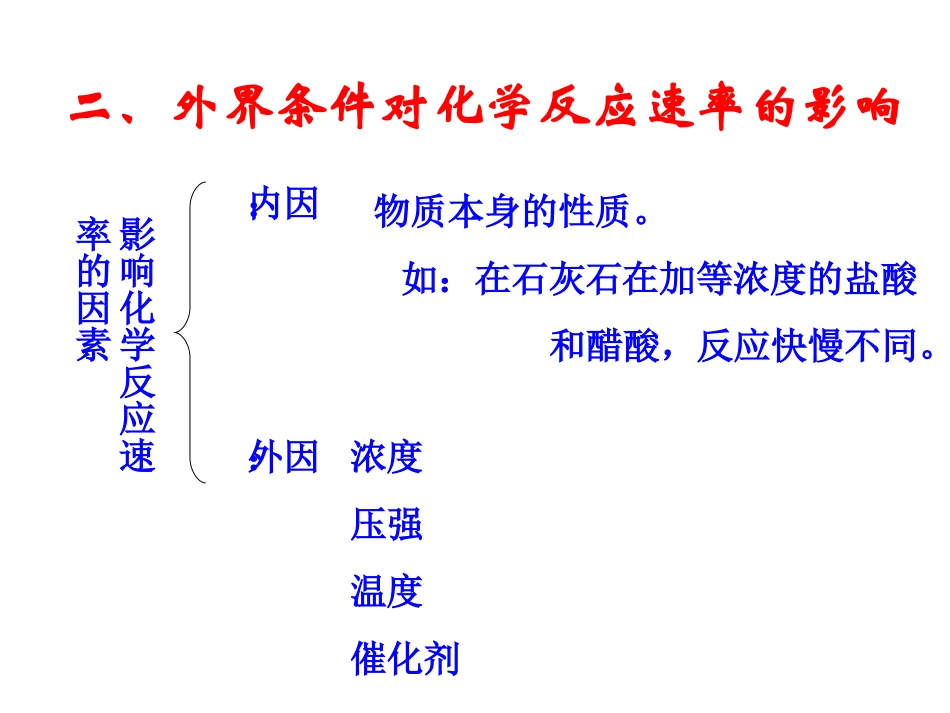
解决两个问题1、反应进行的快慢、即化学反应速率的问题2、反应进行的程度、即化学平衡问题二、外界条件对化学反应速率的影响影响化学反应速率的因素内因:外因:物质本身的性质。如:在石灰石在加等浓度的盐酸和醋酸,反应快慢不同。浓度压强温度催化剂1、浓度对化学反应的影响当其他条件不变时,增加反应物的浓度,可以增大化学反应速率原因:反应物分子——原子——生成物分子键断键合分子普通分子(绝大多数)活化分子(足够高的能量)合适的取向吸热放热有效碰撞一定条件下,活化分子在反应物分子中所占的百分数是一定的。浓度越大,单位体积里所含的分子数越多,活化分子数也就越多,单位时间内的有效碰撞次数也相应增多,化学反应速率就增大。2、压强对化学反应速率的影响1mol气体1mol气体加压压力增大1倍,气体的体积缩小一半,气体的浓度增大1倍,单位体积里活化分子数增大1倍,化学反应速率增大。3、温度对化学反应速率的影响普通分子升温活化分子浓度一定时,升高温度,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子,增加了活化分子的百分数,使有效碰撞次数增多,因而使化学反应速率增大。实验证明:温度每升高10°C,化学反应速率通常增大到原来的2~4倍。【思考】:已知温度每升高10°C,化学反应速率增大了3倍,某反应原来的反应温度是10°C,现在的反应温度是80°C。现在反应的速率是原来的多少倍?分析:每升高10°C,V1=4V原现共升高7个10°C,V现=47V原=16384V原4、催化剂对化学反应速率的影响催化剂能降低反应所需要的能量,这样使得更多的分子成为活化分子,即提高单位体积里活化分子的百分率,使化学反应速率大大增加。未加催化剂反应所需的能量加入催化剂反应所需的能量练习1、把下列四种X溶液,分别加入4个盛有10ml2mol/L盐酸的烧杯中,均加水稀释到50ml,此时X和盐酸缓和地进行反应。其中反应速率最大的是()A、20ml3mol/L的X溶液B、20ml2mol/L的X溶液C、10ml4mol/L的X溶液D、10ml2mol/L的X溶液A2.在2SO2(g)+02(g)2S03(g)反应中,反应物的消耗速率,产物的生成速率之间的关系不正确的是()A.v(SO2)=v(O2)=v(S03)B.v(02)=v(S02)C.v(S02)=v(S03)D.v(S03)=2v(02)3.可逆反应mA+nBxC(A、B、C均为气体),已知v(A)=amol·L-1·s-1,v(B)=bmol·L-1·s-1,v(C)=cmol·L-1·s-1,则x的值为()A.B.C.D.nbcmacbncamc4.将O.6molX气体和O.4molY气体混合于2L容器中,发生反应3X(g)+Y(g)===nZ(g)+2W(g),5min末已生成O.2molW。若测得v(Z)=O.01mol·L-1·min-1,则n值为______,此时X的浓度为________,Y的转化率为________。5.对于可逆反应2S02(g)+02(g)2SO3(g)(正反应为放热反应),下列有关说法正确的是()A.升高温度正反应加快,逆反应不变B.升高温度正逆反应都加快C.升高温度逆反应加快,正反应不变D.升高温度逆反应加快,正反应减慢6.下列各组溶液,同时开始反应,出现浑浊最早的()A.10℃时5mLO.1mol·L-1Na2S203与5mLO.1mol·L-1H2S04溶液混合B.10℃时50mLO.05mol·L-1Na2S203与5mLO.1mol·L-1H2S04溶液混合C.20℃时5mLO.1mol·L-1Na2S203与5mLO.1mol·L-1H2SO4溶液混合D.20℃时50mLO.5mol·L-1Na2S203与5mLO.1mol·L-1H2SO4溶液混合7.下列说法正确的是()A.合成氨反应使用催化剂使原来不能发生的反应变为可以发生的反应B.增大压强对溶液的反应几乎没有影响C.升高温度可以使放热反应速率增大,也可使吸热反应速率增大D.如果反应是放热的,则反应开始时就不需要加热8.对于反应4A+2B3C,下列说法正确的是()A.某温度时,化学反应速率无论用A、B、C何种物质表示,其数值相同B.其他条件不变,降低温度,一般是反应速率减慢C.其他条件不变时,增大压强,单位体积内活化分子百分数一定增大,化学反应速率一定加快D.若增加或减少A物质的量,反应速率一定会发生明显的变化9.100mL、6mol·L-1H2S04与过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成H2的总质量,可向反应物中加适量的……………()A.碳酸钠固体B.水C.硫酸锌溶液D.硫酸铵固体10.对于反应:NO+CO2N02+CO在密闭容器中进行,下列哪些条件加快该反应的速...