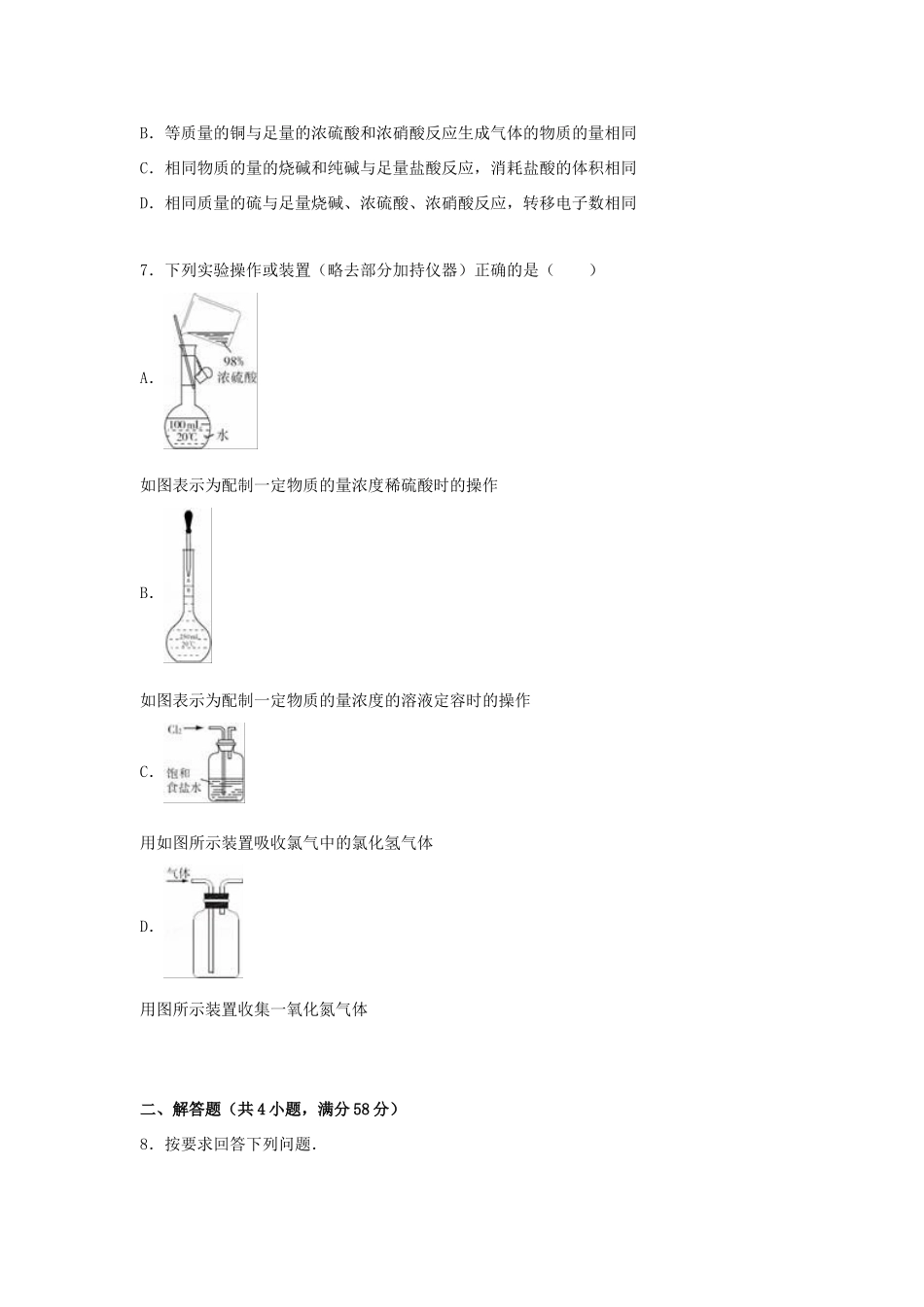
2015-2016学年山东省德州市武城二中高三(上)第二次月考化学试卷一、选择题(本题包括7小题.每小题6分,共42分。每小题只有一个选项符合题意)1.下表中对应关系错误的是()ANaCl=Na++Cl﹣NH3H2O⇌NH4++OH﹣均属于电离方程式BBa2++SO42﹣=BaSO4↓HCO3﹣+OH﹣=CO32﹣+H2O均可表示一类反应CSO2使酸性高锰酸钾溶液褪色;SO2使碱性酚酞溶液褪色均属于SO2的同一性质DCl2+2NaOH=NaClO+H2O+NaCl;3S+6NaOH=2Na2S+Na2SO3+3H2OCl2和S在反应中即作氧化剂又作还原剂A.AB.BC.CD.D2.下列关于Fe2(SO4)3的叙述正确的是(设NA为阿伏加德罗常数的数值)()A.1mol/L的Fe2(SO4)3溶液中含有2NA个Fe3+(不考虑水解)B.1mol的Fe2(SO4)3和S2﹣反应可转移2NA个电子C.在该溶液中,K+、NH4+、I﹣、SO42﹣可以大量共存D.与Cu反应的离子方程式为:Fe3++Cu═Fe2++Cu2+3.CO2中的一个O原子被S原子代替后,即为羰基硫(OCS),羰基硫是一种有臭鸡蛋气味的无色气体,高温下分解为CO和S.下列有关说法正确的是()A.OCS中S的化合价为+4价B.羰基硫分解时,CO是氧化产物C.每有1molOCS分解,能生成22.4LCOD.OCS中含有共价键,属于非电解质4.下列由相关实验现象所推出的结论正确的是()A.铁在常温下不溶于浓硝酸,说明铁与浓硝酸不反应B.将氯气溶于水后溶液呈浅黄绿色,说明氯气与水没有完全反应C.将某气体通入品红溶液中溶液褪色,说明该气体一定是二氧化硫D.向溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42﹣5.下列有关图象的叙述错误的是()A.图可表示向酸化的AlCl3溶液中逐滴加入稀氨水,沉淀量与氨水体积的关系B.图中可表示向澄清石灰水中通入二氧化碳气体,沉淀量与二氧化碳体积的关系C.图中可表示向亚硫酸溶液中通入硫化氢,沉淀量与硫化氢气体的关系D.图中可表示向碳酸钠溶液中逐滴加入稀盐酸,HCO3﹣离子的量与盐酸体积的关系6.硫酸、盐酸和硝酸与烧碱和纯碱并称为工业上的“三酸两碱”.下列说法正确的是()A.等质量的铝与足量的烧碱和盐酸反应生成氢气的质量相同B.等质量的铜与足量的浓硫酸和浓硝酸反应生成气体的物质的量相同C.相同物质的量的烧碱和纯碱与足量盐酸反应,消耗盐酸的体积相同D.相同质量的硫与足量烧碱、浓硫酸、浓硝酸反应,转移电子数相同7.下列实验操作或装置(略去部分加持仪器)正确的是()A.如图表示为配制一定物质的量浓度稀硫酸时的操作B.如图表示为配制一定物质的量浓度的溶液定容时的操作C.用如图所示装置吸收氯气中的氯化氢气体D.用图所示装置收集一氧化氮气体二、解答题(共4小题,满分58分)8.按要求回答下列问题.(1)某小组同学探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).①打开活塞a,逐滴加入H2SO3溶液到过量,烧瓶内溶液变为无色,该反应的离子方程式为,得出的结论是:H2SO3的氧化性比Br2的氧化性(填“强”或“弱”).②再打开活塞b,向所得溶液中逐滴加入H2O2,刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色,变橙黄色反应的离子方程式为,得出的结论是H2O2的氧化性比Br2的氧化性(填“强”或“弱”).(2)某学习小组向盛有氯化钡溶液的试管中通入二氧化硫气体,发现有白色沉淀,为了清楚沉淀的物质,研究小组向试管中加入过量稀盐酸,沉淀不溶解,你认为沉淀物是,产生该物质可能的原因是.(3)为探究SO2使品红溶液褪色的原因,该小组同学将干燥的SO2气体通入品红的四氯化碳溶液中,发现品红不褪色,由此所得出的结论正确的是(填编号)a.SO2使品红溶液褪色的微粒一定不是SO2分子b.SO2使品红溶液褪色的微粒一定是H2SO3分子c.此实验无法确定SO2使品红溶液褪色的微粒d.将干燥的SO2气体通入品红的酒精溶液中,能使品红褪色由此可猜想使品红溶液褪色的微粒可能是.(4)配平并完成下列离子方程式MnO4﹣+H2O2+=Mn2++O2+H2O每有1mol高锰酸根参加反应,生成molO2.9.硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物,一种用硼镁矿(Mg2B2O5H2O)制取单质硼的工艺流程图如图:回答下列问题:(1)Mg2B2O5H2O中B的化合价为.(...