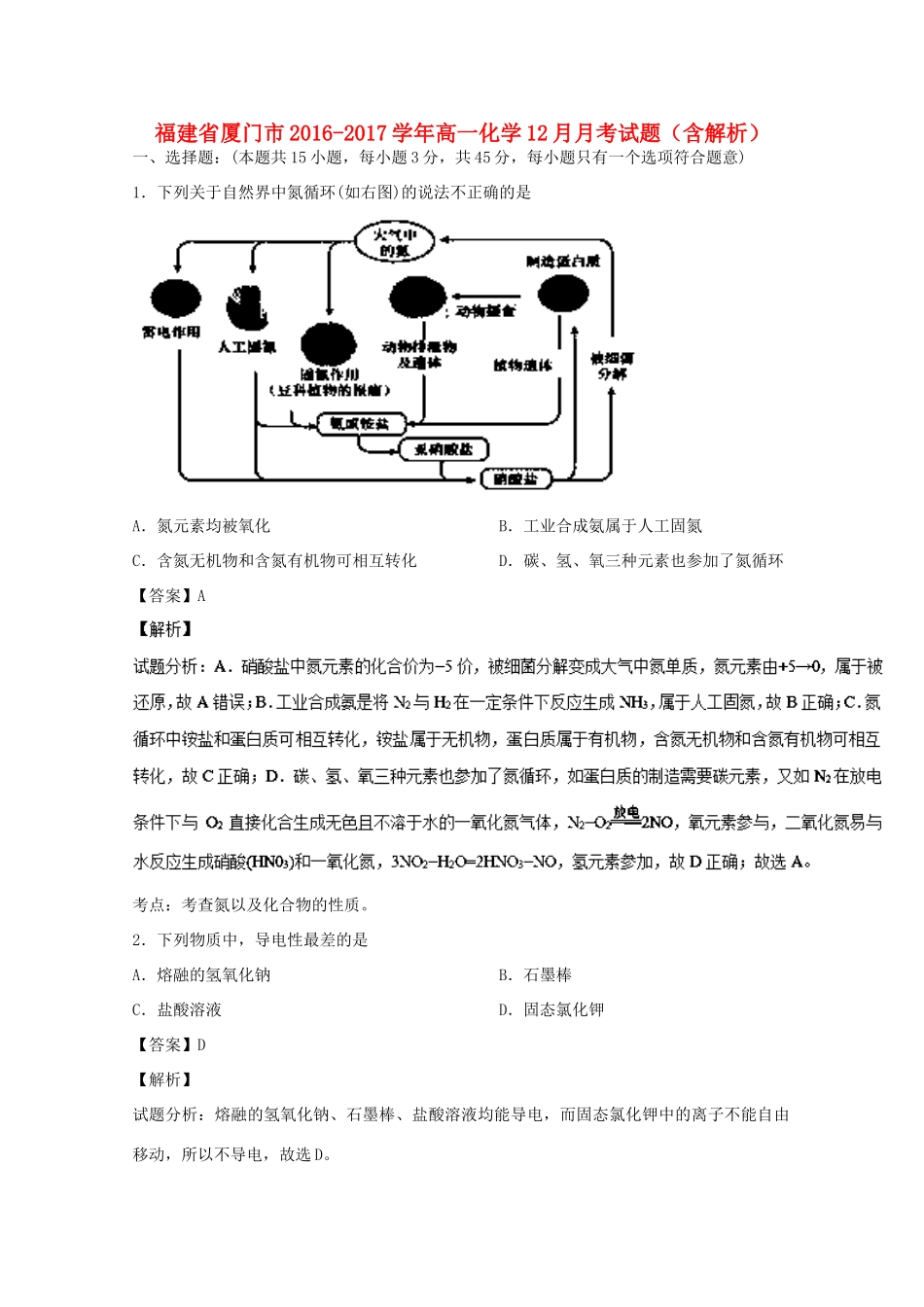
福建省厦门市2016-2017学年高一化学12月月考试题(含解析)一、选择题:(本题共15小题,每小题3分,共45分,每小题只有一个选项符合题意)1.下列关于自然界中氮循环(如右图)的说法不正确的是A.氮元素均被氧化B.工业合成氨属于人工固氮C.含氮无机物和含氮有机物可相互转化D.碳、氢、氧三种元素也参加了氮循环【答案】A考点:考查氮以及化合物的性质。2.下列物质中,导电性最差的是A.熔融的氢氧化钠B.石墨棒C.盐酸溶液D.固态氯化钾【答案】D【解析】试题分析:熔融的氢氧化钠、石墨棒、盐酸溶液均能导电,而固态氯化钾中的离子不能自由移动,所以不导电,故选D。考点:考查电解质溶液的导电性3.物质的量相等的下列气体,常温下在密闭容器中混合,完全反应后容器内压强降低最多的是A.NH3和O2B.NO和O2C.H2和Cl2D.HCl和NH3【答案】D考点:考查常见气体的性质及气体的压强与物质的量之间的关系。4.“绿色化学实验”已走进课堂,在实验室的下列做法符合“绿色化学”的是①收集氨气采用图1所示装置②做氯气与钠反应实验时采用图2所示装置③用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验④采用图3所示装置进行铜与稀硝酸的反应A.②③④B.①②③C.①②④D.①③④【答案】C【解析】试题分析:①实验室收集氨气采用图1所示装置,在制备的过程中用带有酚酞的水能够检验氨气是否收集满,还能够吸收溢出的氨气防止污染环境,符合绿色化学的要求,故①正确;②实验室中做氯气与钠的反应实验时采用图2所示装置,用沾有碱液的棉团可以吸收多余的氯气,防止污染环境,符合绿色化学的范畴,故②正确;③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验,挥发的氯化氢和氨气会污染大气,因此不符合绿色化学的要求,故③错误;④实验室中采用图3所示装置进行铜与稀硝酸的反应,生成的氮的氧化物及时收集在气球里面,也可以做到防止污染环境,符合绿色化学的要求,故④正确;根据分析可知,符合要求的为①②④,故选C。考点:考查绿色化学的理念及应用。5.已知镁和稀硝酸反应时,参加反应的镁和稀硝酸的物质的量之比为2:5,则硝酸的还原产物可能是A.NO2B.N2OC.N2O3D.NO【答案】B【考点定位】以镁和硝酸的反应为载体考查氧化还原反应计算【名师点晴】侧重考查分析计算能力,利用转移电子守恒进行计算是解题关键,Mg与稀硝酸反应时,其物质的量之比为2:5,其中一部分作酸生成Mg(NO3)2,一部分作氧化剂,根据化学式知,起酸作用的硝酸与镁的物质的量之比为2:1,所以作氧化剂的硝酸与Mg的物质的量之比为1:2,根据转移电子相等确定硝酸还原产物。6.已知下列氧化剂均能氧化+4的硫(元素)。为了除去稀H2SO4中的H2SO3,宜选用的氧化剂是A.HNO3B.Cl2C.H2O2D.Na2O2【答案】C【解析】试题分析:HNO3、Na2O2、Cl2等与H2SO3反应生成杂质,得不到纯净的H2SO4,而H2O2与H2SO3反应生成H2SO4和水,没有引入新的杂质,故选C。【考点定位】考查物质的分离和提纯,涉及氧化还原反应的性质。【名师点晴】混合物的分离提纯,为高频考点,掌握常见物质的性质、混合物分离提纯的方法为解答此类试题的关键。需要注意的是,在除杂时,所加除杂质的试剂必须“过量”,只有过量才能除尽欲除杂质,由过量试剂引入的新的杂质必须除尽,同时分离和除杂质的途径必须选择最佳方案(操作简单、常见)。7.重金属离子有毒性。实验室有甲、乙两种废液,均有一定毒性。甲废液经检验呈碱性,主要有毒离子为Ba2+离子,将甲乙两种废液按一定比例混合,溶液的毒性和碱性都明显降低。则乙废液中可能含有的离子是A.Cu2+和So42-B.Cu2+和Cl-C.K+和SO42-D.Ag+和No3-【答案】A【解析】试题分析:A.首先铜离子有毒,又会和氢氧根离子生成氢氧化铜沉淀,其次,钡离子和硫酸根离子会生成硫酸钡沉淀,故A正确;B.氯离子不会将钡离子转化为沉淀,不会使毒性明显降低,故B错误;C.钾离子无毒,而乙溶液有毒,故C错误;D.所有的硝酸盐都溶于水,不会将钡离子转化为沉淀,故D错误;故选A。考点:考查离子之间的沉淀转换问题。8.下列离子方程式中正确的是A.FeSO4溶液中通入Cl2:Fe2++Cl2==Fe3++2Cl-B....