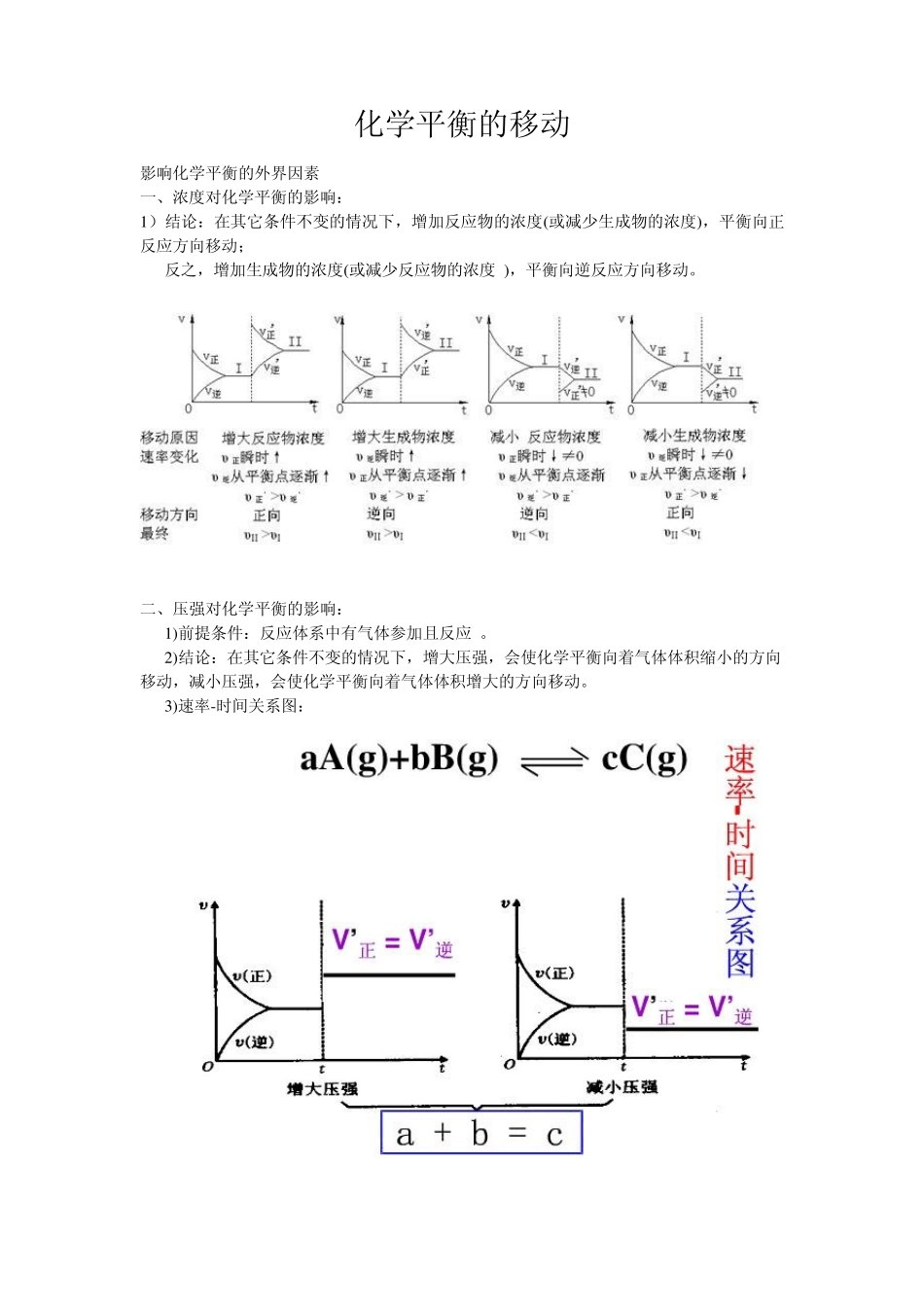
化学平衡的移动 影响化学平衡的外界因素 一、浓度对化学平衡的影响: 1 )结论:在其它条件不变的情况下,增加反应物的浓度(或减少生成物的浓度),平衡向正反应方向移动; 反之,增加生成物的浓度(或减少反应物的浓度 ),平衡向逆反应方向移动。 二、压强对化学平衡的影响: 1 )前提条件:反应体系中有气体参加且反应 。 2 )结论:在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动,减小压强,会使化学平衡向着气体体积增大的方向移动。 3 )速率-时间关系图: 注意: 增大体系的压强,平衡不移动,但浓度增大,颜色加深,速率加快! 2.充入”惰性气体” a 恒压 当成”减压” b 恒容 速率不变,平衡不移动 三、温度对化学平衡的影响: 结论:在其它条件不变的情况下,升高温度,平衡向吸热反应方向移动。 降低温度,平衡向放热反应方向移动。 1.例: I2 + H2 2HI △ 四、催化剂对化学平衡的影响: 催化剂对可逆反应的影响:同等程度改变化学反应速率,V ’正= V ’逆,只改变反应到达平衡所需要的时间,而不影响化学平衡的移动。 平衡移动的结果 影响平衡的条件 平衡移动的方向 平衡移动的结果 浓度 增大反应物 向正向移动 使反应物浓度减小 减小生成物 使生成物浓度增大 减小反应物 向逆向移动 使反应物浓度增大 增大生成物 使生成物浓度减小 压强 增大压强 向体积缩小移动 使压强减小 减小压强 向体积增大移动 使压强增大 温度 升高温度 向吸热方向移动 使温度降低 降低温度 向放热方向移动 使温度升高 要引起化学平衡的移动,必须是由于外界条件的改变而引起 V 正≠ V 逆。 平衡移动原理(勒夏特列原理):改变影响化学平衡的一个条件(如浓度、压强、或温度),平衡就向能减弱这种改变的方向移动。 练习: 1.关于催化剂的叙述,正确的是 ( ) A.催化剂在化学反应前后性质不变 B.催化剂在反应前后质量不变,故催化剂不参加化学反应 C.使用催化剂可以改变反应达到平衡的时间 D.催化剂可以提高反应物的转化率 2.对于可逆反应 2A2(g)+B2(g) 2A2B(1)(正反应为放热反应)达到平衡,要使正、逆反应的速率都增大,而且平衡向右移动,可以采取的措施是 ( ) A.升高温度 B.降低温度 C.增大压强 D.减小压强 3.在一容积固定的密闭容器中,反应 2SO2(g)+O2(g) 2SO3(g)达平衡后,再通入 18O2 气体,重新达平衡。有关下...