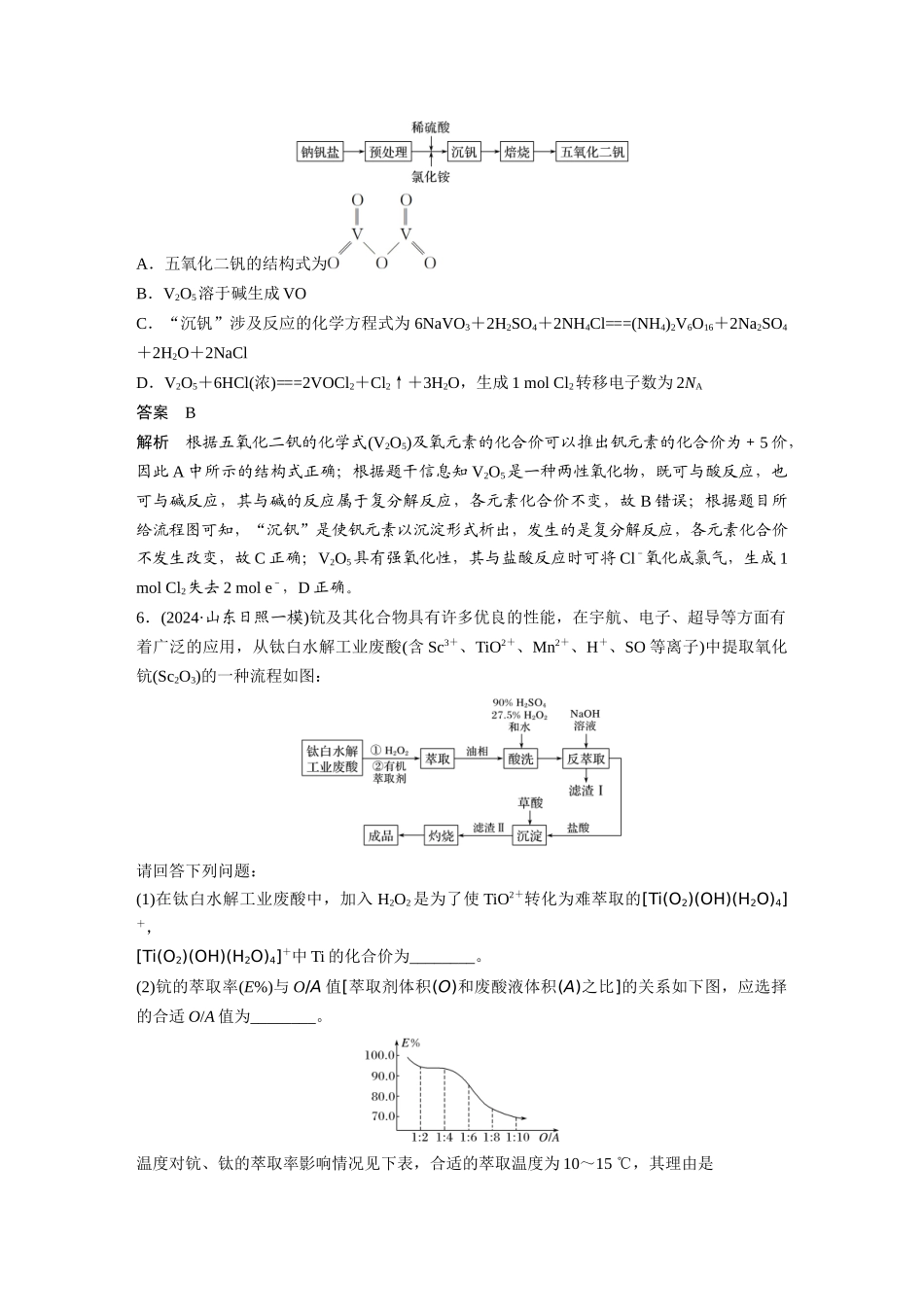
专项提能特训 3 从氧化还原反应的视角分析“化工生产”中的物质变化1.分解水制氢的一种原理如图,下列关于该原理的说法正确的是( )A.反应过程中化合价改变的元素共有 H、O、SB.涉及的反应类型只有分解反应和化合反应C.理论上,每生成 16 g O2,就能得到标准状况下 22.4 L H2D.理论上,每分解 18 g H2O,就需向体系内再补充 32 g SO2答案 C解析 反应Ⅰ:SO2+2H2O+I2===H2SO4+2HI;反应Ⅱ:2HI=====H2↑+I2;反应Ⅲ:2H2SO4=====2SO2↑+2H2O+O2↑。2.碱式硫酸铁[Fex(OH)y(SO4)z](其中 Fe 元素为+3 价)是一种新型高效絮凝剂。一种利用废铁屑(含 Fe 和少量 Al2O3、Fe2O3)生产碱式硫酸铁的工艺流程如下 :下列说法正确的是( )A.x、y、z 一定符合关系式:x=y=zB.“过滤”所得滤液中只含溶质 FeSO4C.“反应Ⅰ”中包含的反应类型有置换反应、化合反应和复分解反应D.在实际生产中,反应Ⅱ常同时通入 O2以减少 NaNO2的用量,若有 11.2 L(标准状况)的 O2参加反应,则相当于节约 4 mol NaNO2答案 C解析 [Fex(OH)y(SO4)z](其中 Fe 元素为+3 价),化合价代数和为 0,x、y、z 一定符合关系式:3x=y+2z,故 A 错误;“过滤”所得滤液中除含溶质 FeSO4外还有 Na2SO4,故 B 错误;由分析可知,“反应Ⅰ”中包含的反应类型有置换反应:Fe+H2SO4===FeSO4+H2↑,化合反应 Fe2(SO4)3 + Fe===3FeSO4 和 复 分 解 反 应 Al2O3 + 3H2SO4===Al2(SO4)3 + 3H2O 、 Fe2O3 +3H2SO4===Fe2(SO4)3+3H2O,故 C 正确;在实际生产中,反应Ⅱ常同时通入 O2 以减少NaNO2的用量,若参加反应的 O2有 11.2 L(标准状况),反应过程中提供电子相等,则相当于节约 NaNO2的物质的量==2 mol。3.用还原法可以将硝酸厂烟气中的大量氮氧化物(NOx)转化为无害物质。常温下,将 NO 与H2的混合气体通入 Ce(SO4)2与 Ce2(SO4)3的混合溶液中,其转化过程如图所示。下列说法不正确的是( )A.反应Ⅰ的离子反应方程式为:2Ce4++H2===2Ce3++2H+B.反应Ⅱ中氧化剂与还原剂的物质的量之比为 1∶2C.反应前溶液中 c(Ce4+)一定等于反应后溶液中的 c(Ce4+)D.反应过程中混合溶液内 Ce3+和 Ce4+的总数一定保持不变答案 C解析 根据图示可知反应Ⅰ为 2Ce4++H2===2Ce3++2H+,A 项正确;反应Ⅱ的反应物为 Ce3+、H+、NO,生成物为 Ce4+、N2、H2O,根据得失电子守恒、电荷守恒...