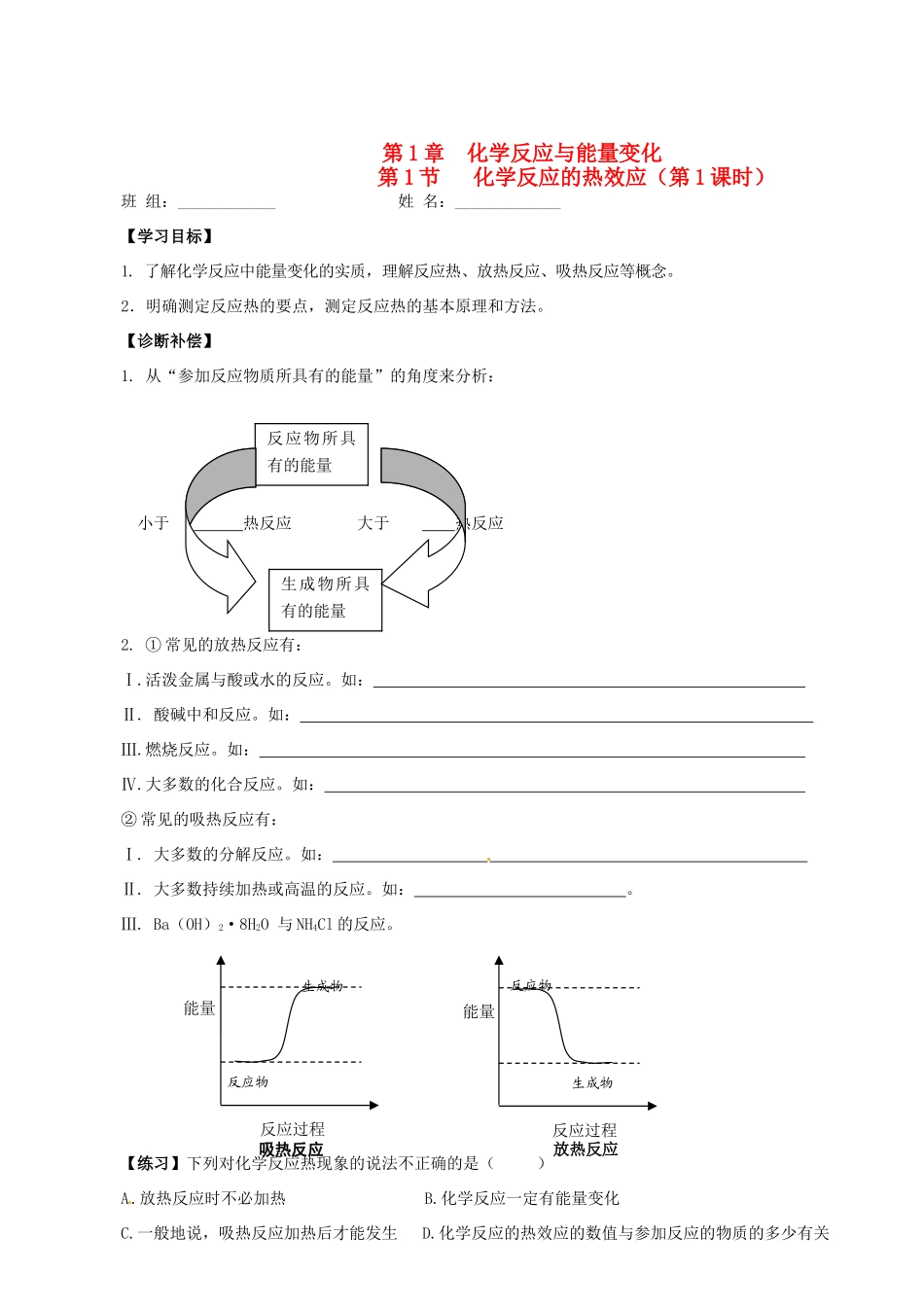
反应物所具有的能量生成物所具有的能量 第 1 章 化学反应与能量变化 第 1 节 化学反应的热效应(第 1 课时)班 组:____________ 姓 名:_____________【学习目标】1. 了解化学反应中能量变化的实质,理解反应热、放热反应、吸热反应等概念。2.明确测定反应热的要点,测定反应热的基本原理和方法。【诊断补偿】1. 从“参加反应物质所具有的能量”的角度来分析: 小于 热反应 大于 热反应2. ① 常见的放热反应有:Ⅰ.活泼金属与酸或水的反应。如: Ⅱ. 酸碱中和反应。如: Ⅲ.燃烧反应。如: Ⅳ.大多数的化合反应。如: ② 常见的吸热反应有:Ⅰ. 大多数的分解反应。如: Ⅱ. 大多数持续加热或高温的反应。如: 。Ⅲ. Ba(OH)2·8H2O 与 NH4Cl 的反应。【练习】下列对化学反应热现象的说法不正确的是( )A.放热反应时不必加热 B.化学反应一定有能量变化C.一般地说,吸热反应加热后才能发生 D.化学反应的热效应的数值与参加反应的物质的多少有关生成物反应物能量反应过程吸热反应生成物反应物能量反应过程放热反应【学海导航】一、化学反应的反应热:(一)反应热1、定义: 2、符号: Q>0 Q Q<0 3、获得 Q 值的方法:(1) (2) ① 4、反应热的分类:② ③ ……(二)中和热1、定义: 理解要点:① 条件:稀溶液。稀溶液是指溶于大量水的离子。② 反应物:(强)酸与(强)碱。中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应。③ 生成 1mol 水,中和反应的实 质是 H+和 OH—化合生成 H20,若反应过程中有其他物质生成,这部分反应热也不在中和热内。④ 放出的热量:57.3kJ/mol2、中和热的表示: 【练习1】为了减小误差,某同学在实验中两次测定中和热。第一次 用50mL0.5mol•L—1的盐酸和50mL0.5mol•L—1NaOH溶液,第二次是用100mL0.5mol•L—1的盐酸和100mL 0.5mol•L—1的NaOH溶液。请你预测该同学两次测得的中和热结果 (相等或不相等)。【阅读】指导学生阅读课本 P3 页,完成:(1)测定中和热的仪器; (2)测定中和热的原理; (3)测定中和热中应该要注意哪些问题?3、中和热的测量(1)仪器: ( 、 、 ) (2)原理:Q= (C 为热容) 或 Q= (C0为比热容)中和热:Q= = 与酸、碱的用量无关。【 练 习 2 】 50ml0.50mol·L-1 盐 酸 与 50mL0.55mol·L-1NaOH 溶 液 在 如下 图 所示的装置中进行中和反应。通过测...