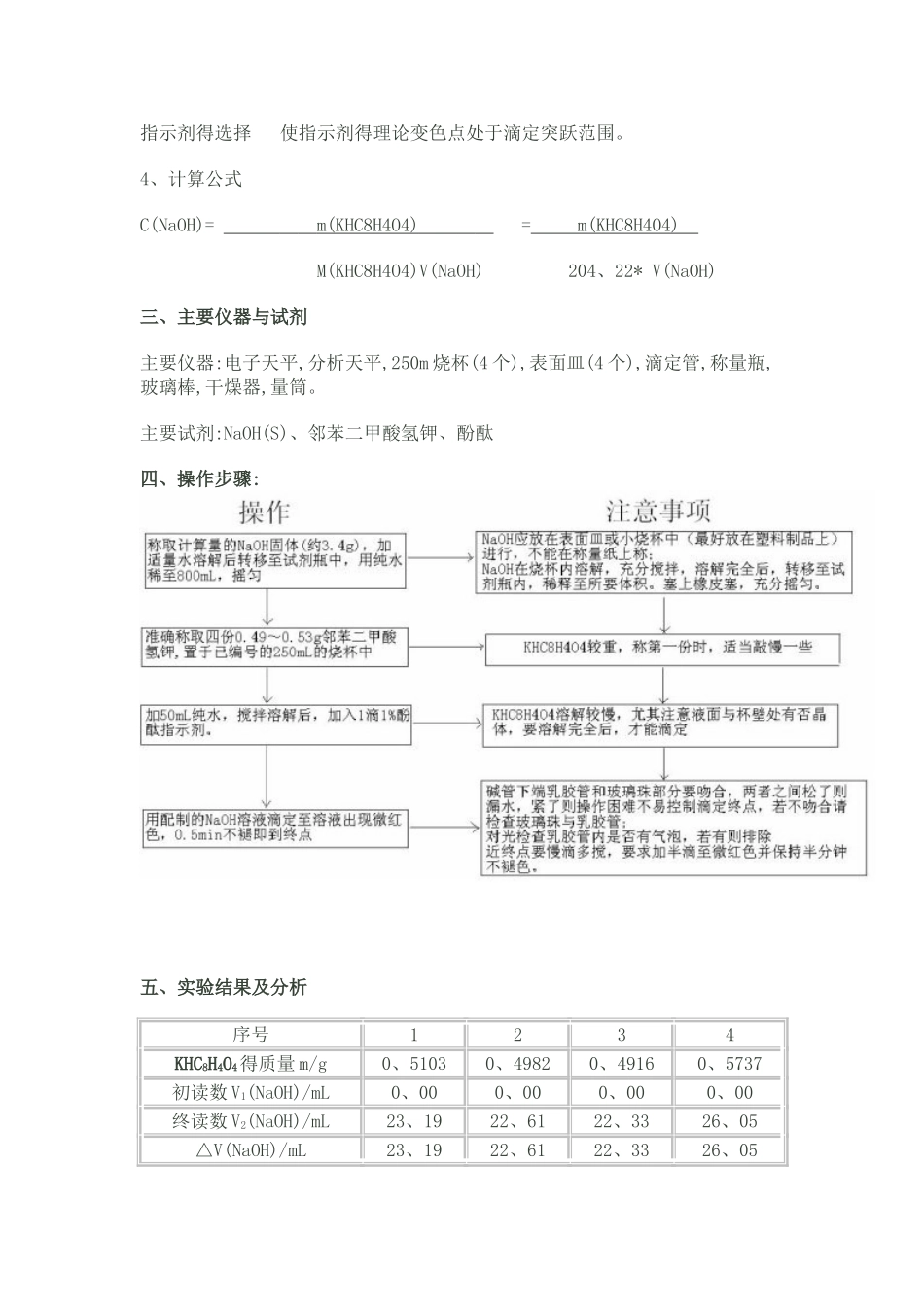
实验七:氢氧化钠浓度得标定一、实验目得1 练习分析天平得使用方法并掌握减量称量法 2 掌握滴定操作并学会正确推断终点;3 学会配制与标定碱标准溶液得方法。二、实验原理:1、氢氧化钠标准溶液不能准确配制得原因;NaOH 易吸湿,不就是基准物质,故不能准确配制 NaOH 标准溶液,需用邻苯二甲酸氢钾标定,属于强碱滴定弱酸。2、标定氢氧化钠溶液得工作基准试剂,滴定反应到达化学计量点时溶液得 pH 值;工作基准试剂就是:邻苯二甲酸氢钾。C6H4COOHCOOK + NaOH → C6H4COONaCOOK + H2O计量点时 pH=9、03、选用何种指示剂,终点时得颜色;选用酚酞作指示剂,终点就是溶液由无色变为淡红色,且 0、5min 内不退色。如何选择指示剂?强碱滴定强酸时,随着 NaOH 溶液得加入,溶液 pH 值发生变化,以 pH 对 NaOH 得加入量作图得滴定曲线,计量点前后 NaOH 溶液由不足到过量 0、02mL(0、1%);溶液 pH 得突然变化称滴定突跃,突跃得 pH 范围称滴定突跃范围;酸碱指示剂、指示剂得变色范围 酸碱指示剂本身就是弱酸或弱碱:HIn = H+ + In-,HIn 与 In-有不同得颜色,pH=pKa(HIn)+lg[In-]/[HIn],当[In-] =[HIn],pH=pKa 为理论变色点;[In-]/[HIn]≤ 0、1 瞧到酸色,≥10,瞧到碱色,变色范围得 pH=pKa±1,但实际观测到得与理论计算有差,因人眼对各种颜色得敏感度不同,加上两种颜色互相掩盖,影响观察。如酚酞 pKa=9、1,变色 pH 范围为 8、0~9、6。不同得人得观察结果也不同。指示剂得选择 使指示剂得理论变色点处于滴定突跃范围。4、计算公式C(NaOH)= m(KHC8H4O4) = m(KHC8H4O4) M(KHC8H4O4)V(NaOH) 204、22* V(NaOH)三、主要仪器与试剂主要仪器:电子天平,分析天平,250m 烧杯(4 个),表面皿(4 个),滴定管,称量瓶,玻璃棒,干燥器,量筒。主要试剂:NaOH(S)、邻苯二甲酸氢钾、酚酞四、操作步骤:五、实验结果及分析序号1234KHC8H4O4得质量 m/g0、51030、49820、49160、5737初读数 V1(NaOH)/mL0、000、000、000、00终读数 V2(NaOH)/mL23、1922、6122、3326、05△V(NaOH)/mL23、1922、6122、3326、05C(NaOH)/mol·L-10、10780、10790、10780、1078C 平均(NaOH)/mol·L-1(舍前)0、1078 S0、00005774 计算 T0、00001、7320、00000、0000查表 3-1 得 T(置信界限95%)1、48 C 平均(NaOH)/mol·L-1(舍后)0、1078 用到得计算公式:1、 C(NaOH)= m(KHC8H4O4) = m(KHC8H4O4) M(KHC8H4O4)V(NaOH) 204、22* V(NaOH)2.平均值得计...