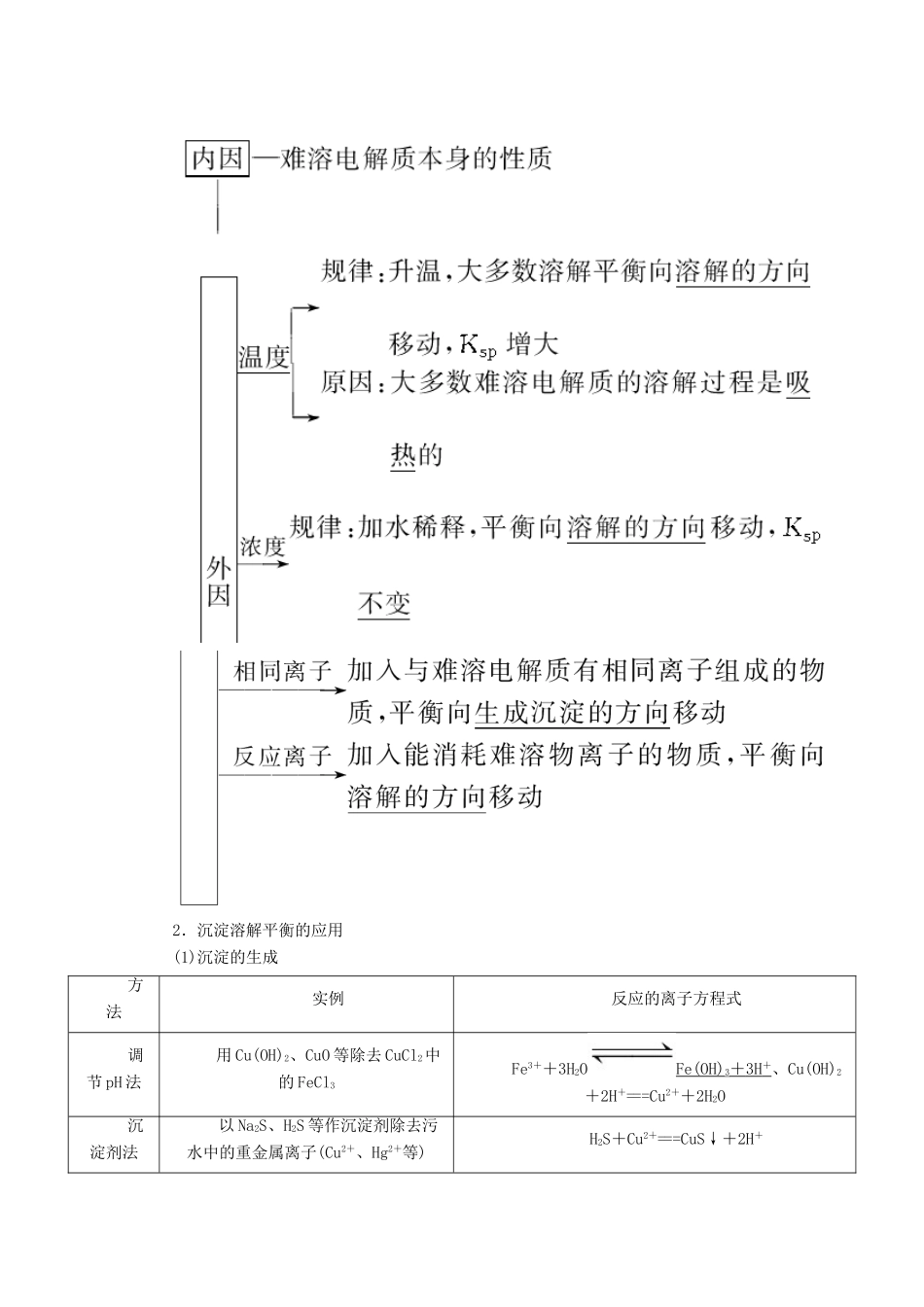
第 29 讲 难溶电解质的溶解平衡考纲要求1.了解难溶电解质的溶解平衡及影响因素。2.了解沉淀溶解平衡的应用。3.理解溶度积的含义及其表达式,能进行相关的计算。考点一 沉淀溶解平衡及其应用1.沉淀溶解平衡(1)电解质在水中的溶解度在 20 ℃时,电解质在水中的溶解度与溶解性的关系如下:(2)溶解平衡的建立过程固体溶质溶液中的溶质(3)特征(4)影响因素 2.沉淀溶解平衡的应用(1)沉淀的生成方法实例反应的离子方程式调节 pH 法用 Cu(OH)2、CuO 等除去 CuCl2中的 FeCl3Fe3++3H2OFe(OH)3+ 3H + 、Cu(OH)2+2H+===Cu2++2H2O沉淀剂法以 Na2S、H2S 等作沉淀剂除去污水中的重金属离子(Cu2+、Hg2+等)H2S+Cu2+===CuS↓+2H+(2)沉淀的溶解① 酸溶解法:如 CaCO3溶于盐酸,离子方程式为 CaCO3+2H+===Ca2++H2O+CO2↑。② 盐溶解法:如 Mg(OH)2 溶于 NH4Cl 溶液,离子方程式为 Mg(OH)2+2NH===Mg 2 + + 2NH3·H2O。(3)沉淀的转化① 实质:沉淀溶解平衡的移动。② 特征:a.一般说来,溶解度小的沉淀转化为溶解度更小的沉淀容易实现。b.沉淀的溶解度差别越大,越容易转化。③ 应用:a.锅炉除垢:将 CaSO4转化为 CaCO3,离子方程式为:CaSO4+CO===CaCO3+SO。b.矿物转化:CuSO4溶液遇 ZnS(闪锌矿)转化为 CuS(铜蓝)的离子方程式为:Cu2+(aq)+ZnS(s)===CuS(s)+Zn2+(aq)。【感悟测评】 判断正误(正确的打“√”,错误的打“×”)(1)向 0.1 mol/L 的 AgNO3溶液中加入过量的盐酸完全反应后溶液中无 Ag+。( )(2)沉淀溶解平衡也属于化学平衡,属于动态平衡,即 [v(溶解)=v(沉淀)≠0]。( )(3)在一定条件下,难溶物达到溶解平衡时,固体质量、离子浓度不再随时间改变而改变。( )(4)外界条件改变,溶解平衡一定发生移动。( )(5)CaCO3===Ca2++CO 与 CaCO3(s)Ca2+(aq)+CO(aq) 所表达的意义分别是CaCO3的电离方程式和沉淀溶解平衡式。( )答案:(1)× (2)√ (3)√ (4)× (5)√1.沉淀溶解平衡的影响因素以 AgCl(s) Ag+(aq)+Cl-(aq) ΔH>0 为例分析外界条件改变对沉淀溶解平衡的影响外界条件移动方向平衡后c(Ag+)平衡后c(Cl-)Ksp升高温度正向增大增大增大加水稀释正向不变不变不变加入少量 AgNO3逆向增大减小不变通入 HCl逆向减小增大不变通入 H2S正向减小增大不变2.难溶电解质的溶解平衡中的易错点(1)沉淀溶解平衡是化学平衡的一种,沉淀溶解平衡移动分析时也同...