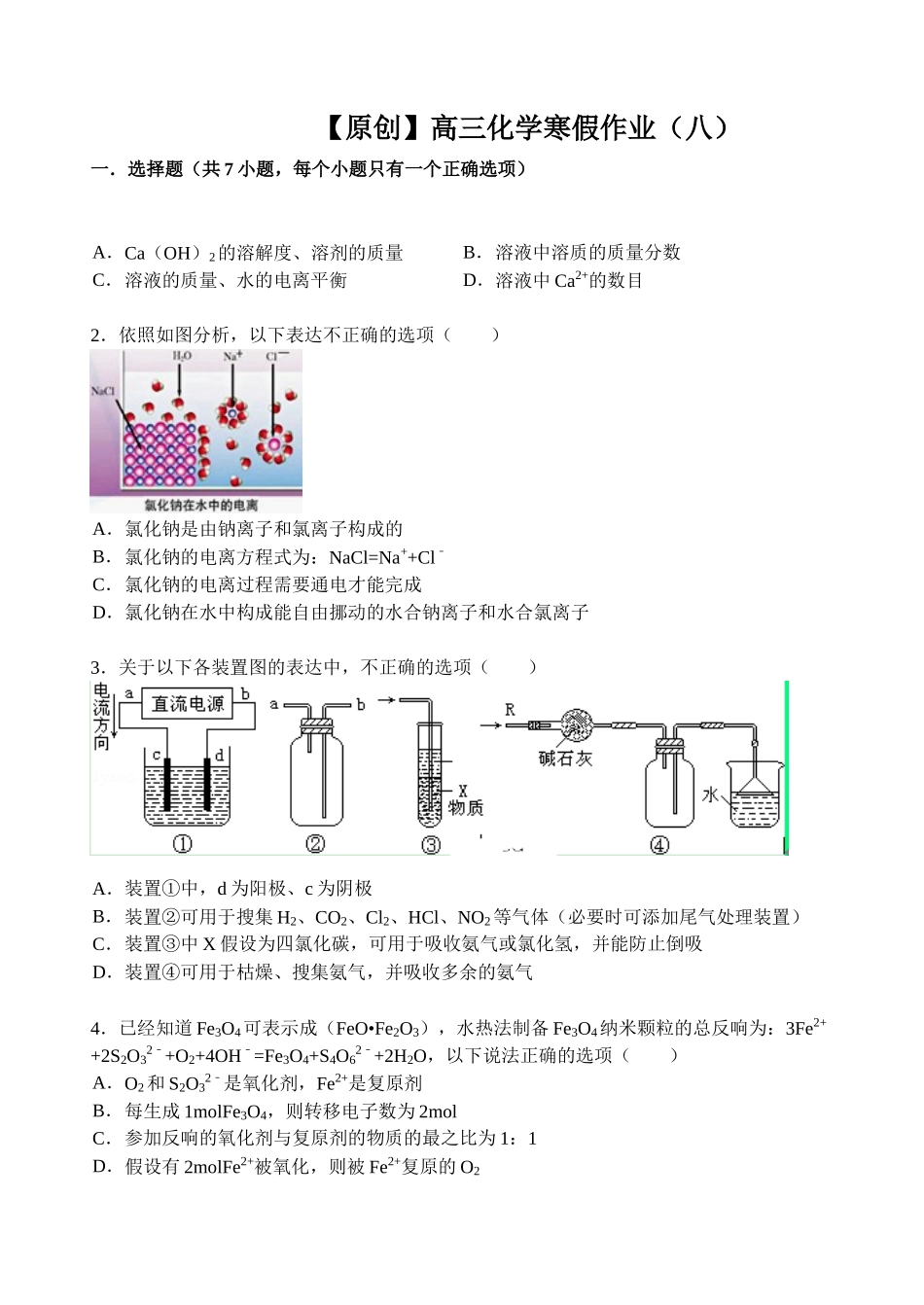
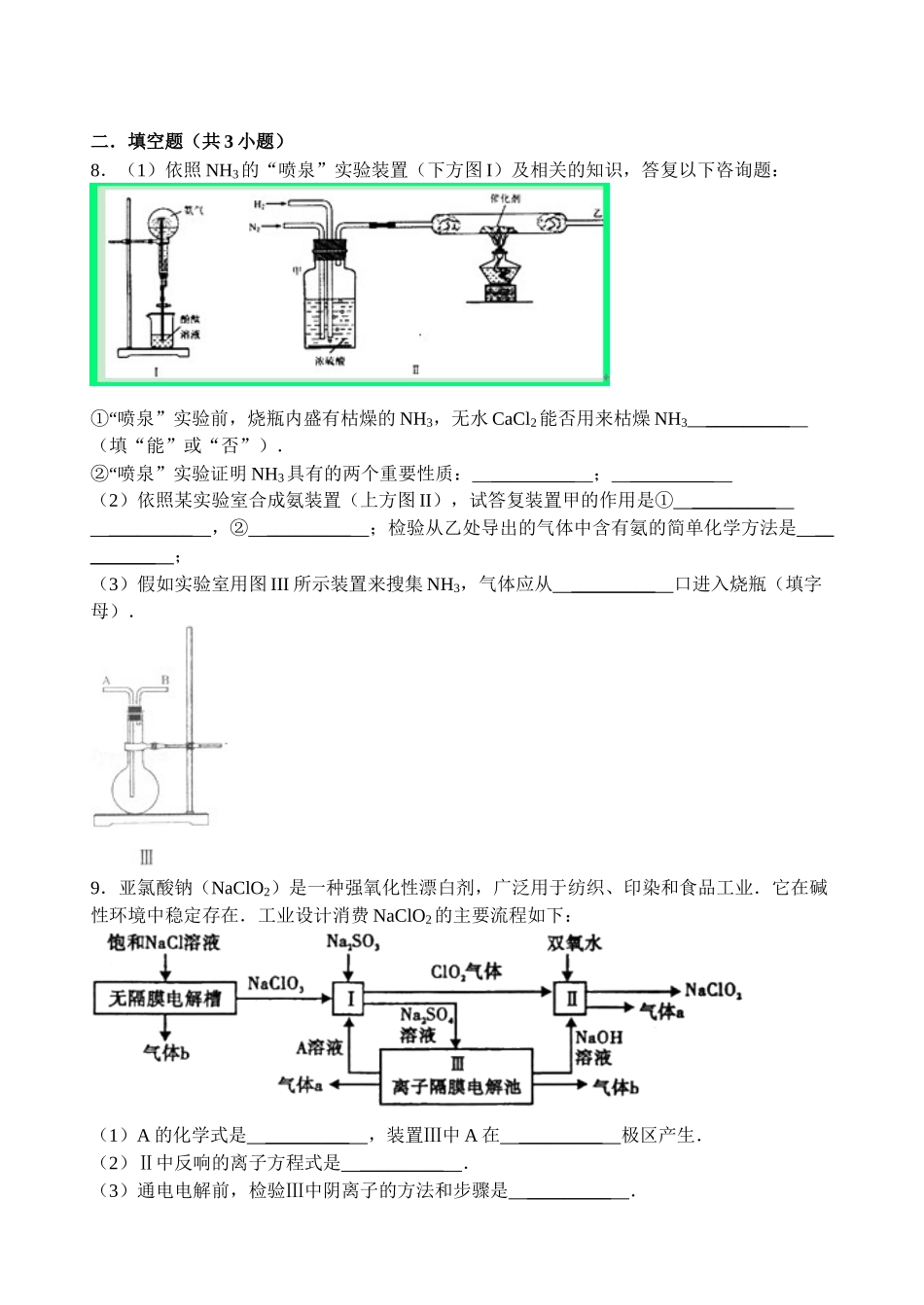
【原创】高三化学寒假作业(八)一.选择题(共7小题,每个小题只有一个正确选项)1.将40℃的饱和石灰水冷却至10℃;或参加少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是()A.Ca(OH)2的溶解度、溶剂的质量B.溶液中溶质的质量分数C.溶液的质量、水的电离平衡D.溶液中Ca2+的数目2.依照如图分析,以下表达不正确的选项()A.氯化钠是由钠离子和氯离子构成的B.氯化钠的电离方程式为:NaCl=Na++Cl﹣C.氯化钠的电离过程需要通电才能完成D.氯化钠在水中构成能自由挪动的水合钠离子和水合氯离子3.关于以下各装置图的表达中,不正确的选项()A.装置①中,d为阳极、c为阴极B.装置②可用于搜集H2、CO2、Cl2、HCl、NO2等气体(必要时可添加尾气处理装置)C.装置③中X假设为四氯化碳,可用于吸收氨气或氯化氢,并能防止倒吸D.装置④可用于枯燥、搜集氨气,并吸收多余的氨气4.已经知道Fe3O4可表示成(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反响为:3Fe2++2S2O32﹣+O2+4OH﹣=Fe3O4+S4O62﹣+2H2O,以下说法正确的选项()A.O2和S2O32﹣是氧化剂,Fe2+是复原剂B.每生成1molFe3O4,则转移电子数为2molC.参加反响的氧化剂与复原剂的物质的最之比为1:1D.假设有2molFe2+被氧化,则被Fe2+复原的O25.以下说法正确的选项()A.AⅠ族元素的金属性一定比ⅡA族元素的金属性强B.AⅥ族元素中氢化物最稳定的其沸点一定最高C.非金属元素构成的化合物中只有共价化合物D.短周期中,同周期元素的离子半径从左到右逐步减少6.右图为实验室制取少量乙酸乙酯的装置图.以下关于该实验的表达中,不正确的选项()A.向a试管中先参加浓硫酸,然后边摇动试管边渐渐参加乙醇,再加冰醋酸B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使反响向生成乙酸乙酯的方向挪动D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇7.有一未知的无色溶液,只可能含有以下离子中的假设干种:H+、NH+4、K+、Mg2+、Cu2+、Al3+、NO﹣3、CO32﹣、SO42﹣,现取三份100mL溶液进展如下实验①第一份加足量AgNO3溶液后,有白色沉淀产生.②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、枯燥后,沉淀质量为.③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.依照上述实验,以下揣测不正确的选项()A.原溶液一定不存在H+、Cu2+、CO32﹣B.不能确定原溶液是否含有K+、NO3﹣C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2D.实验所加的NaOH的浓度为2mol•L1﹣二.填空题(共3小题)8.(1)依照NH3的“喷泉”实验装置(下方图I)及相关的知识,答复以下咨询题:“①喷泉”实验前,烧瓶内盛有枯燥的NH3,无水CaCl2能否用来枯燥NH3_________(填“能”或“否”).“②喷泉”实验证明NH3具有的两个重要性质:_________;_________(2)依照某实验室合成氨装置(上方图II),试答复装置甲的作用是①__________________,②_________;检验从乙处导出的气体中含有氨的简单化学方法是_________;(3)假如实验室用图III所示装置来搜集NH3,气体应从_________口进入烧瓶(填字母).9.亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.工业设计消费NaClO2的主要流程如下:(1)A的化学式是_________,装置Ⅲ中A在_________极区产生.(2)Ⅱ中反响的离子方程式是_________.(3)通电电解前,检验Ⅲ中阴离子的方法和步骤是_________.(4)为防止Ⅱ中制各的NaClO2被复原成NaCl,应选适宜的复原剂,除双氧水外,还能够选择的复原剂是_________(填字母编号).a.Na2O2b.FeCl2c.Na2S(5)常温时,HClO2的电离平衡常数Ka=1.07×102﹣mol•L1﹣,Ⅱ中反响所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中=_________.(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200mL,05mol•L1﹣的CuSO4溶液.生成铜,如今所得溶液中离子浓度由大到小的顺序是_________.10.某小组同学为探究H2O2、H2SO3...