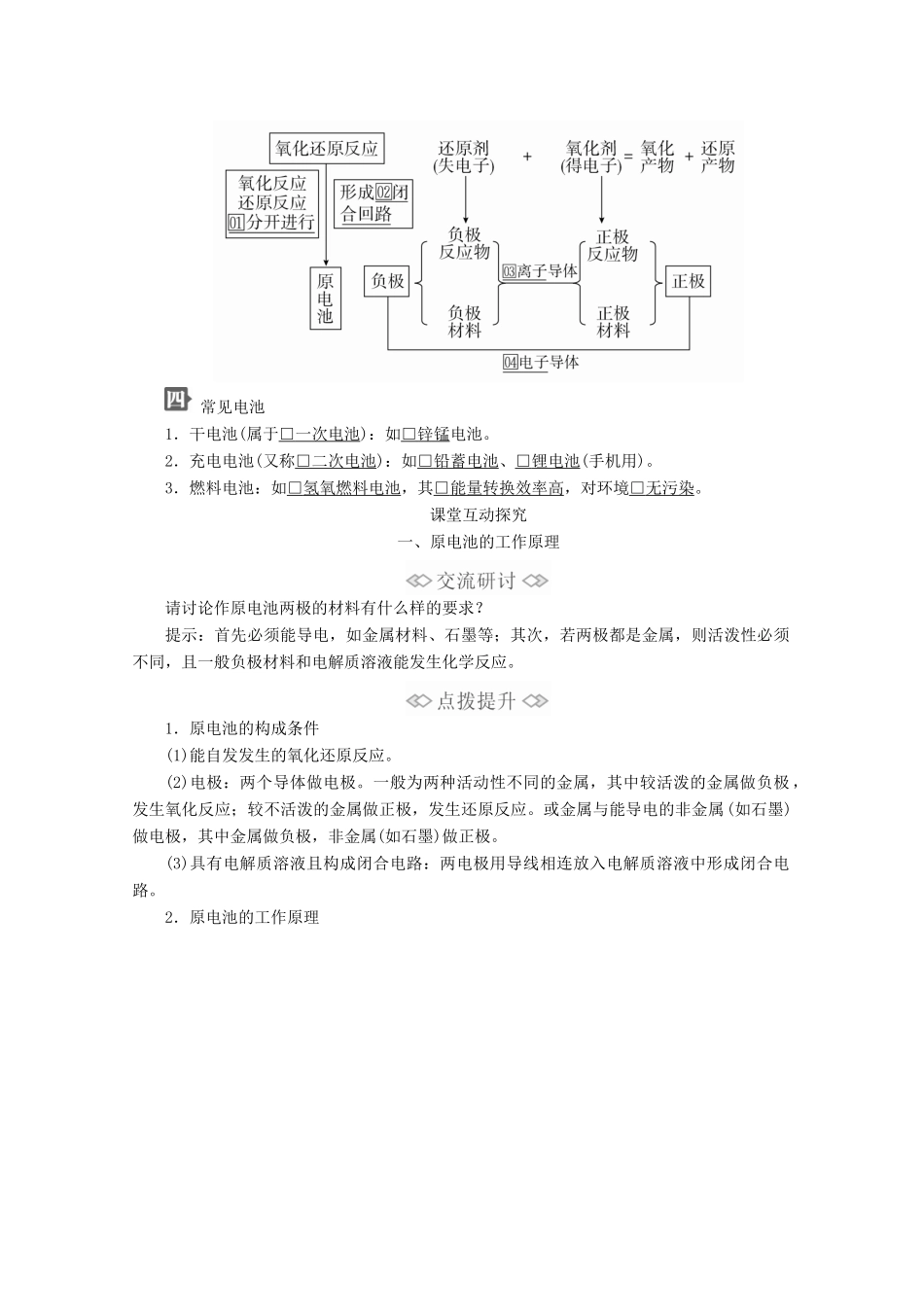
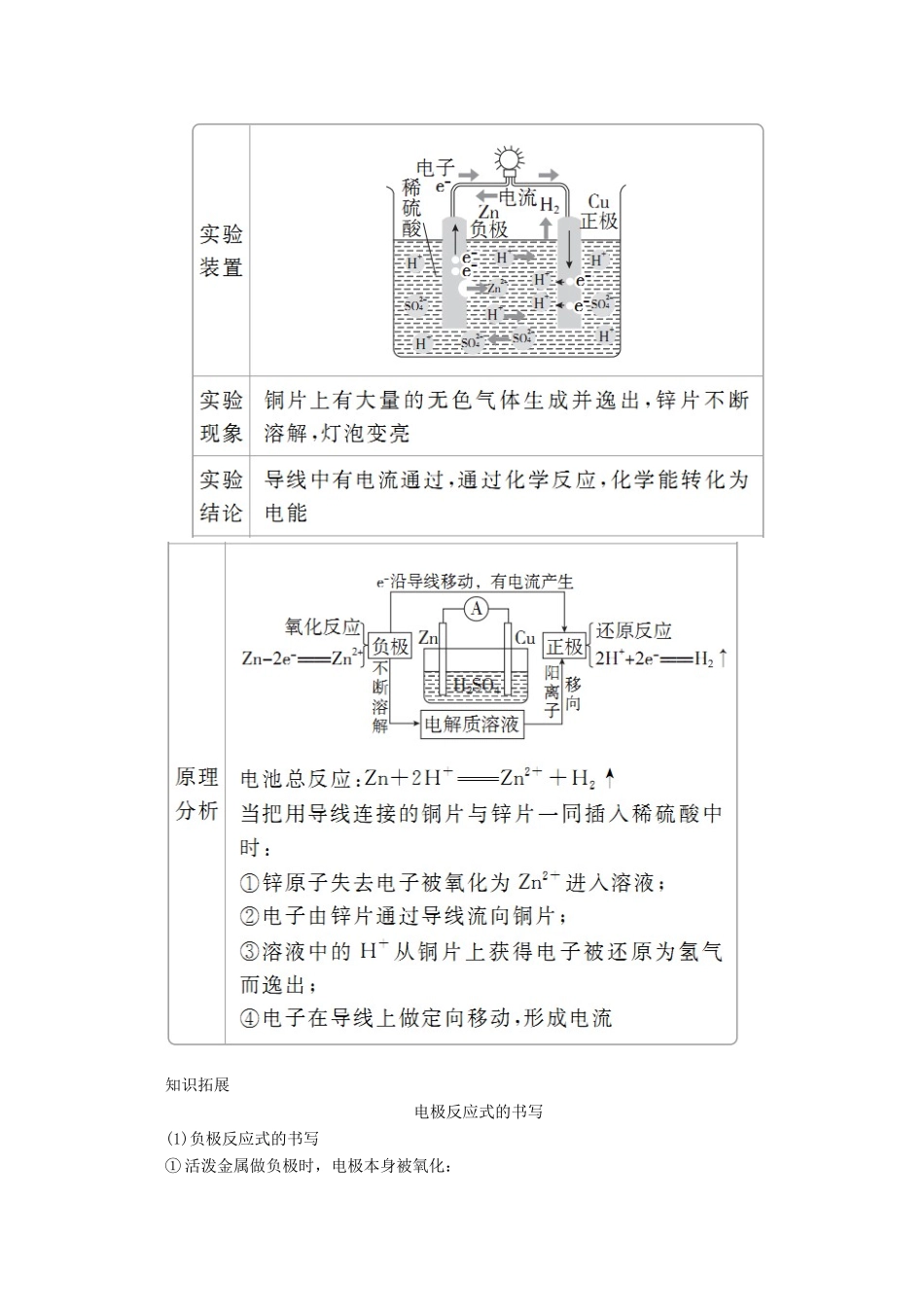
第2课时化学反应能量转化的重要应用——化学电池核心素养发展重点学业要求体会化学电池对提高生活质量的重要意义,体会化学科学对社会发展的贡献,强化绿色化学观念和可持续发展意识。1.了解原电池的构成和工作原理。2.知道构成原电池的条件。3.了解化学能与电能的相互转化以及化学反应的其他应用。4.了解常见的化学电池。学生自主学习氢氧燃料电池化学电池是根据□原电池原理制成的。原电池是一种利用□氧化还原反应将□化学能直接转化成□电能的装置。在氢氧燃料电池中,氧化反应与还原反应分别在□两个不同的区域进行。其中氢气分子中的氢原子在左侧石墨电极上□失去电子,氢气作为电池的□负极反应物;氧气分子中氧原子在右侧石墨电极上□得到电子,氧气作为电池的□正极反应物。稀硫酸中存在□自由移动的离子起到□传导电荷的作用,导线起到□传导电子的作用。物理学认为,在一个有电源的闭合回路中,产生电流的原因是电源给用电器提供了□电势差。简易氢氧燃料电池能够给用电器提供电势差,是由于在两个石墨电极上有□得失电子能力不同的物质——氢气和氧气;当形成闭合回路时便会产生□电流。原电池的基本工作原理□还原剂和□氧化剂分别在不同的区域发生□氧化反应和□还原反应,并通过能导电的物质形成□闭合回路产生□电流。其中,还原剂在□负极上□失去电子,是负极反应物;氧化剂在□正极上□得到电子,是正极反应物;电极材料通常是能够□导电的固体。此外,还要有能够□传导电荷的电解质作为离子导体;而导线则作为□电子导体,起到传导电子形成闭合回路的作用。设计原电池的基本思路常见电池1.干电池(属于□一次电池):如□锌锰电池。2.充电电池(又称□二次电池):如□铅蓄电池、□锂电池(手机用)。3.燃料电池:如□氢氧燃料电池,其□能量转换效率高,对环境□无污染。课堂互动探究一、原电池的工作原理请讨论作原电池两极的材料有什么样的要求?提示:首先必须能导电,如金属材料、石墨等;其次,若两极都是金属,则活泼性必须不同,且一般负极材料和电解质溶液能发生化学反应。1.原电池的构成条件(1)能自发发生的氧化还原反应。(2)电极:两个导体做电极。一般为两种活动性不同的金属,其中较活泼的金属做负极,发生氧化反应;较不活泼的金属做正极,发生还原反应。或金属与能导电的非金属(如石墨)做电极,其中金属做负极,非金属(如石墨)做正极。(3)具有电解质溶液且构成闭合电路:两电极用导线相连放入电解质溶液中形成闭合电路。2.原电池的工作原理知识拓展电极反应式的书写(1)负极反应式的书写①活泼金属做负极时,电极本身被氧化:a.若生成的阳离子不与电解质溶液反应,其产物可直接写为金属阳离子,如:Zn-2e-===Zn2+,Cu-2e-===Cu2+。b.若生成的金属阳离子与电解质溶液反应,其电极反应式为两反应合并后的反应式。如MgAl(KOH)原电池,负极反应式为Al-3e-+4OH-===[Al(OH)4]-;铅蓄电池负极反应式:Pb-2e-+SO===PbSO4。②负极本身不反应时,常见书写方法为:氢氧(酸性)燃料电池,负极反应式为H2-2e-===2H+。氢氧(碱性)燃料电池,负极反应式为H2-2e-+2OH-===2H2O。(2)正极反应式的书写①首先根据化合价变化或氧化性强弱判断得电子的微粒;②其次确定该微粒得电子后变成哪种形式。如氢氧(酸性)燃料电池,正极反应式为O2+4H++4e-===2H2O。氢氧(碱性)燃料电池,正极反应式为O2+2H2O+4e-===4OH-。1.下列各装置能构成原电池的是()答案C解析A项,只有一个电极,所以该装置不能构成原电池,错误;B项,该装置没有构成闭合回路,所以不能构成原电池,错误;C项,该装置符合原电池的构成条件,能构成原电池,正确;D项,酒精不是电解质溶液,所以不能构成原电池,错误。2.如图所示装置中,观察到电流表指针偏转(指针顺着电流方向偏转),M变粗,N变细,由此判断下表中所列M、N、P三种物质,其中可以成立的是()MNPA锌铜稀硫酸B铜铁稀盐酸C银锌硝酸银溶液D锌铁硝酸铁溶液答案C解析该原电池中M变粗,N变细,说明发生原电池反应时N溶解,N做负极,溶液中有金属析出附着在M上,M做正极。A、B两项中,电解质溶液分别为稀硫酸和稀盐酸...