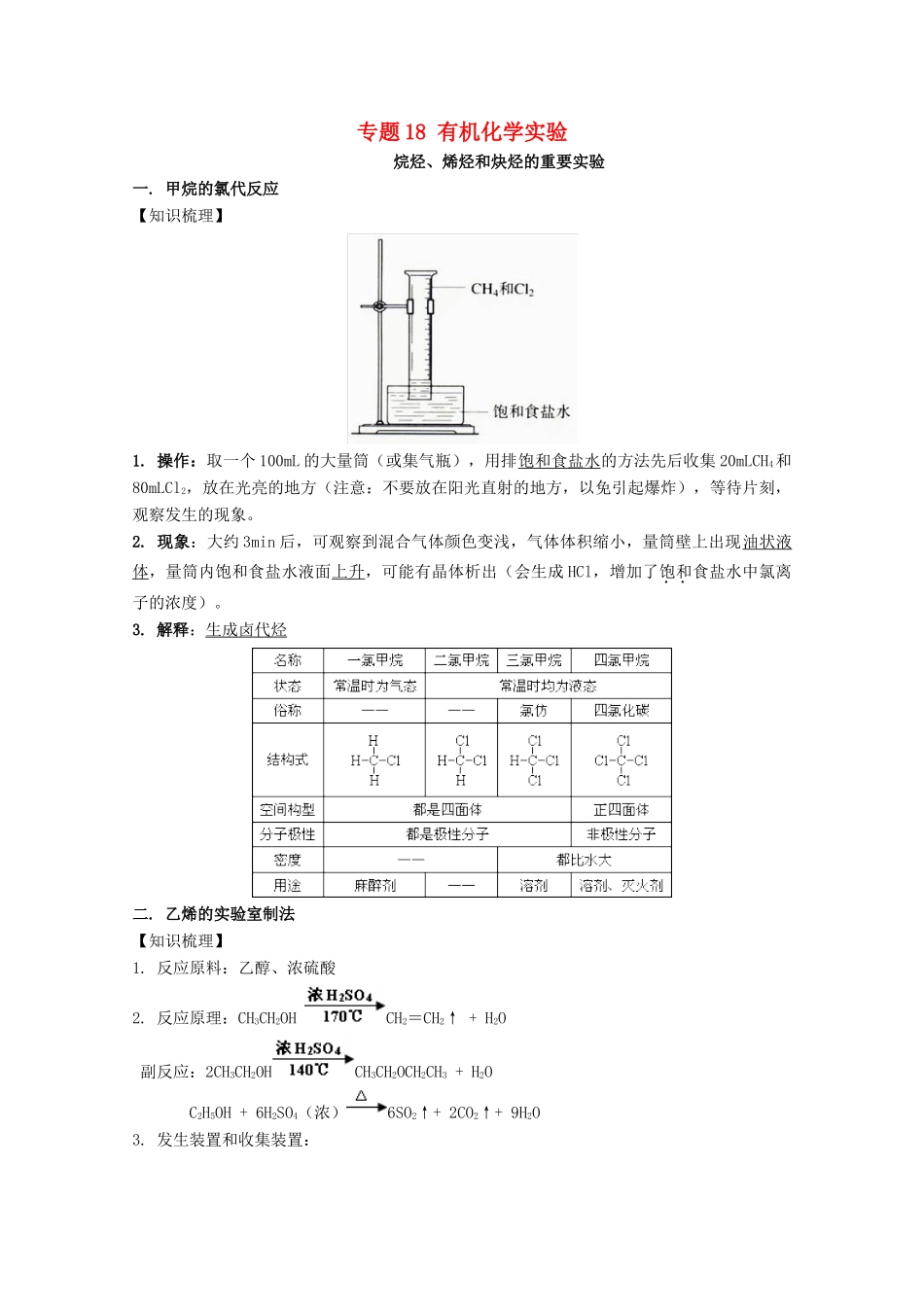
专题18有机化学实验烷烃、烯烃和炔烃的重要实验一.甲烷的氯代反应【知识梳理】1.操作:取一个100mL的大量筒(或集气瓶),用排饱和食盐水的方法先后收集20mLCH4和80mLCl2,放在光亮的地方(注意:不要放在阳光直射的地方,以免引起爆炸),等待片刻,观察发生的现象。2.现象:大约3min后,可观察到混合气体颜色变浅,气体体积缩小,量筒壁上出现油状液体,量筒内饱和食盐水液面上升,可能有晶体析出(会生成HCl,增加了饱和食盐水中氯离子的浓度)。3.解释:生成卤代烃二.乙烯的实验室制法【知识梳理】1.反应原料:乙醇、浓硫酸2.反应原理:CH3CH2OHCH2=CH2↑+H2O副反应:2CH3CH2OHCH3CH2OCH2CH3+H2OC2H5OH+6H2SO4(浓)6SO2↑+2CO2↑+9H2O3.发生装置和收集装置:发生装置:l+lg(圆底烧瓶、酒精灯、温度计等)收集装置:排水法,不能用排空气法。4.尾气处理:点燃法【深度讲解】⑴配制乙醇和浓硫酸体积比为1:3的混合液应注意:应将浓硫酸缓缓注入乙醇并不断摇匀。使用过量的浓硫酸可提高乙醇的利用率,增加乙烯的产量。⑵温度计水银球(或液泡)应插入反应混和液,液面以下,但不能接触瓶底,以便控制反应温度为170℃。⑶反应时应迅速升温到170℃。(目的是为了减少副反应的发生)⑷为防止加热过程中液体爆沸,应在反应液中加少许碎瓷片。⑸如控温不当,会发生副反应,是制得的乙烯中混有CO2、SO2、乙醚等杂质,必须通过浓NaOH溶液(或碱石灰)后,才能收集到比较纯净的乙烯。⑹若实验时,已开始给浓硫酸跟乙醇的混合物加热一段时间,忽然记起要加碎瓷片,应先停止加热,冷却到室温后,在补加碎瓷片。⑺浓硫酸的作用是:催化剂、脱水剂。⑻实验结束时,要先将导气管从水中取出,再熄灭酒精灯,反之,会导致水被倒吸。要想不被倒要把水中的导管先拿出来⑼点燃乙烯前要验纯。三.乙炔的实验室制法【知识梳理】1.反应原料:电石(主要成分为CaC2)、水(用饱和食盐水代替)2.反应原理:CaC2+2H2OCa(OH)2+CH≡CH↑副反应:CaS+2H2OCa(OH)2+H2S↑Ca3P2+6H2O3Ca(OH)2+2PH3↑Ca3As2+6H2O3Ca(OH)2+2AsH3↑3.发生装置和收集装置:发生装置:S+lg(广口瓶(或锥形瓶、烧瓶、大试管等)、分液漏斗等)收集装置:排水法。4.尾气处理:点燃法【深度讲解】⑴不能用启普发生器制乙炔:a.反应产物Ca(OH)2微溶于水,呈糊状堵塞反应容器,使水面难以升降;b.反应速率快且放出大量的热,会损坏启普发生器。⑵电石与水反应很剧烈,应选用分液漏斗,通过控制水流的速度,来控制产生乙炔的速度。⑶电石与水反应剧烈,用饱和食盐水代替水可减缓反应速率,获得平稳的乙炔气流。⑷由于电石中含有其他杂质(如:CaS、Ca3P2、Ca3As2等)。使制得的乙炔中含有(H2S、PH3、AsH3等)难闻的气体。要想制得较纯净的CH≡CH可将气体通过盛有CuSO4溶液或NaOH溶液的洗气瓶。⑸得到平稳的乙炔气流:①常用饱和氯化钠溶液代替水(减小浓度)②分液漏斗控制流速③并加棉花,防止泡沫喷出。【拓展】⑴由于电石中含有其他杂质(如:CaS、Ca3P2、Ca3As2等)。使制得的乙炔中含有(H2S、PH3、AsH3等)难闻的气体。要想制得较纯净的CH≡CH可将气体通过盛有CuSO4溶液的洗气瓶。⑵电石与水反应很剧烈,可以采取下列措施来控制反应速率:①用饱和食盐水代替水。②通过分液漏斗滴加饱和食盐水。四.石蜡的催化裂化【知识梳理】(1)反应原料:石蜡、氧化铝(或分子筛)(2)原理:CnH2n+2Cn1H2n1+Cn2H2n2+2(3)反应装置:【深度讲解】⑴氧化铝或分子筛的作用:催化剂。⑵装置Ⅱ中冷水的作用:冷凝裂化气。⑶装置Ⅱ中小试管中收集到的液体的成分有烷烃和烯烃。⑷装置Ⅲ中小试管中的现象是酸性KmnO4溶液褪色。五.石油的分馏【知识梳理】1.反应原料:原油2.反应原理:利用加热和冷凝(蒸馏),把石油分成不同沸点范围的馏分。3.反应装置:蒸馏烧瓶、酒精灯、温度计、冷凝器(冷凝管)、锥形瓶等。【深度讲解】⑴温度计水银球(或液泡)应位于蒸馏烧瓶支管口略低处,测定的是馏分蒸气的温度。⑵冷凝器中冷凝水的流向与气流反向相反,应从下口入水上口出水。⑶为防止爆沸,反应混合液中需加入少量碎瓷片。例1实验室制备1,2-二溴...