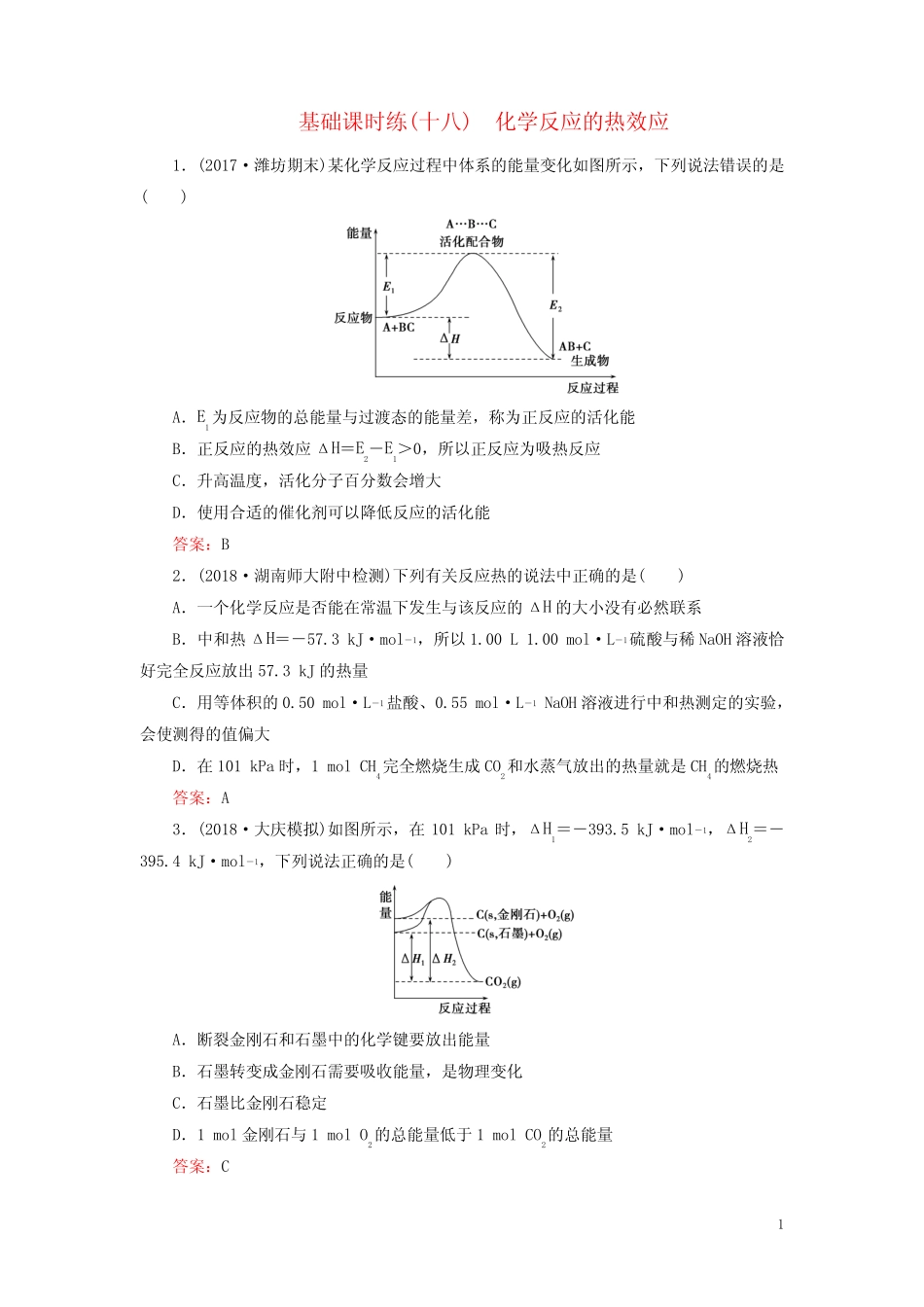
1基础课时练(十八)化学反应的热效应1.(2017·潍坊期末)某化学反应过程中体系的能量变化如图所示,下列说法错误的是()A.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能B.正反应的热效应ΔH=E2-E1>0,所以正反应为吸热反应C.升高温度,活化分子百分数会增大D.使用合适的催化剂可以降低反应的活化能答案:B2.(2018·湖南师大附中检测)下列有关反应热的说法中正确的是()A.一个化学反应是否能在常温下发生与该反应的ΔH的大小没有必然联系B.中和热ΔH=-57.3kJ·mol-1,所以1.00L1.00mol·L-1硫酸与稀NaOH溶液恰好完全反应放出57.3kJ的热量C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大D.在101kPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热答案:A3.(2018·大庆模拟)如图所示,在101kPa时,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,下列说法正确的是()A.断裂金刚石和石墨中的化学键要放出能量B.石墨转变成金刚石需要吸收能量,是物理变化C.石墨比金刚石稳定D.1mol金刚石与1molO2的总能量低于1molCO2的总能量答案:C24.(2017·天津期末)向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示。下列说法正确的是()A.反应HCO-3(aq)+H+(aq)===CO2(g)+H2O(l)为放热反应B.CO2-3(aq)+2H+(aq)===CO2(g)+H2O(l)ΔH=ΔH1+ΔH2+ΔH3C.ΔH1>ΔH2,ΔH2<ΔH3D.H2CO3(aq)===CO2(g)+H2O(l),若使用催化剂,则ΔH3变小解析:选B由题图可知,反应物具有的总能量低于生成物具有的总能量,则反应HCO-3(aq)+H+(aq)===CO2(g)+H2O(l)为吸热反应,A错误;反应CO2-3(aq)+2H+(aq)===CO2(g)+H2O(l)分三步进行:CO2-3(aq)+2H+(aq)―→HCO-3(aq)+H+(aq)―→H2CO3(aq)―→CO2(g)+H2O(l),则该反应的ΔH=ΔH1+ΔH2+ΔH3,B正确;由图可知,反应CO2-3(aq)+2H+(aq)===HCO-3(aq)+H+(aq)放出的能量比反应HCO-3(aq)+H+(aq)===H2CO3(aq)放出的能量多,则有ΔH1<ΔH2,C错误;使用催化剂能改变反应的活化能,从而改变反应速率,但反应热不变,故ΔH3不变,D错误。5.已知:C(s)+H2O(g)===CO(g)+H2(g)ΔH=akJ·mol-12C(s)+O2(g)===2CO(g)ΔH=-220kJ·mol-1H—H键、O===O键和O—H键的键能分别为436kJ·mol-1、496kJ·mol-1和462kJ·mol-1,则a为()A.-332B.-118C.+350D.+130解析:选D根据盖斯定律,由第一个反应×2-第二个反应得,2H2O(g)===O2(g)+2H2(g)ΔH=(2a+220)kJ·mol-1。根据反应热与键能的关系计算,则2a+220=4×462-(436×2+496),解得a=+130。本题选D。6.(2017·大庆实验中学期末)下列有关热化学方程式的评价合理的是()选项实验事实热化学方程式评价A若H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3kJ·mol-1,将稀硫酸和NaOH溶液混合H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l)ΔH=-57.3kJ·mol-1正确3B醋酸和稀NaOH溶液混合CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l)ΔH=-57.3kJ·mol-1不正确,因为醋酸的状态为“l”,而不是“aq”C160gSO3气体与足量液体水反应生成H2SO4放出热量260.6kJSO3(g)+H2O(l)===H2SO4(aq)ΔH=-130.3kJ·mol-1不正确;因为反应热ΔH=-260.6kJ·mol-1D1molC8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出534kJ的热量2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l)ΔH=-1068kJ·mol-1正确解析:选DH+与OH-反应生成1molH2O(l)时,ΔH=-57.3kJ·mol-1,则H2SO4(aq)与NaOH(aq)反应生成2molH2O(l)时,ΔH应为2×(-57.3)kJ·mol-1,A错误。醋酸为弱电解质,电离过程中吸收热量,ΔH不是-57.3kJ·mol-1;CH3COOH的状态标注合理,B错误。160gSO3气体的物质的量为160g80g·mol-1=2mol,与足量液体水反应生成H2SO4放出热量260.6kJ,则1molSO3(g)反应时,ΔH=-130.3kJ·mol-1,热化学方程式书写正确,C错误。1molC8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l)放出534kJ热量,则2molC8H18(l)完全燃烧的ΔH=-1068kJ·mol-1,热化学方程式书写正确,D正确。7.(2018·株洲质检)...