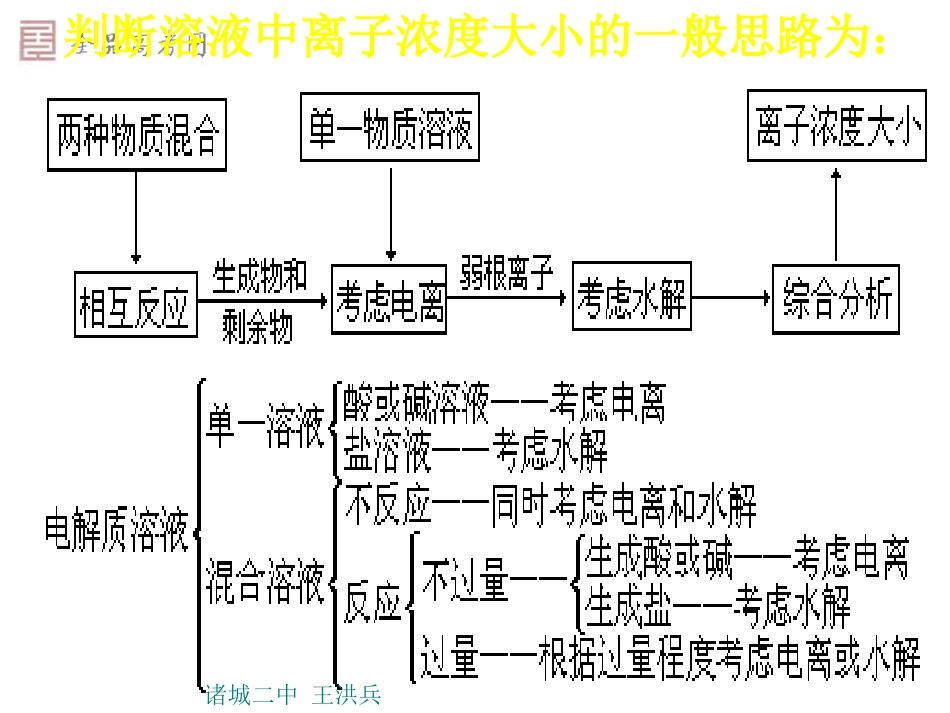
判断溶液中离子浓度大小的一般思路为:诸城二中王洪兵【例3】比较NH4Cl溶液中离子浓度的大小?【例1】CH3COOH溶液中有哪些微粒?比较离子浓度大小关系。【例2】H2S溶液中离子浓度大小关系?[H2S]>[H+]>[HS-]>[S2-]>[OH-][CH3COOH]>[H+]>[CH3COO-]>[OH-]CCl->CNH4+>CH+>COH-2、溶质为一种盐•①考虑电解质的电离,将其电离成离子•②考虑“弱离子”的水解•③c(不水解离子)>c(水解离子)•④根据溶液的酸碱性得出CH+和COH-的大小.•一、若溶液中只含有一种溶质•1、溶质为弱酸或弱碱•①考虑弱电解质的电离非常微弱。•c(不电离分子)>c(离子)•②多元弱酸分步电离•c(第一步电离得到的离子)>c(第二步离子)注意:1、若溶液中含有等物质的量浓度的CH3COO-和CH3COOH,NH4+和NH3.H2O等两种或两种以上溶质。2、一般主要考虑弱电解质的电离(电离程度大于水解程度),特殊情况则应根据题目条件推导.二、若溶液中有两种溶质【例4】物质的量相同CH3COOH和CH3COONa溶液中离子浓度大小关系。【例5】物质的量相同NH4Cl和NH3.H2O溶液中离子浓度大小关系。[CH3COO-]>[Na+]>[H+]>[OH-][NH4+]>[Cl-]>[OH-]>[H+](1)两物质不反应((22)两种物质反应。)两种物质反应。1、等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是()[M+]>[A-]>[OH-]>[H+][NH4+]>[Cl-]>[OH-]>[H+]2、将PH=2的盐酸与PH=12的氨水等体积混合,在所得的混合溶液中,下列关系式正确的是()注意:先考虑反应溶液中的溶质,然后再比较浓度大小。分析:两物质完全反应,所以反应后溶液中的溶质为MA分析:两物质反应,氨水过量所以反应后溶液中的溶质为:NH4Cl和NH3.H2O三、溶液中离子的电荷守恒电荷守恒:溶液中阴、阳离子所带的正、负电荷数值相等,电解质溶液呈电中性.如在Na2CO3溶液中存在着Na+、CO32-、H+、OH-、HCO3-,它们存在如下关系:C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-)注意:①写出溶液中离子数②电荷数=C物质×离子的电荷四、物料守恒(原子守恒)指电解质溶液中某一部分的原始浓度c应等于它在溶液中各种存在形式的浓度之和如在Na2CO3溶液中CO32-能水解,故碳元素以CO32-、HCO3-、H2CO3三种形式存在,它们之间的守恒关系为:C(Na+)=2[C(CO32-)+C(HCO3-)+C(H2CO3)]•质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例:0.1mol/LNa2CO3溶液中:[OH-]=[H+]+[HCO3-]+2[H2CO3]练习:将10mL0.1mol·L-1氨水与12mL0.1mol·L-1的HCl混合后,溶液中各种离子物质的量浓度由大到小的顺序应是:()A.c(Cl—)>c(NH4+)>c(OH—)>c(H+)B.c(Cl—)>c(NH4+)>c(H+)>c(OH—)C.c(H+)>c(OH—)>c(Cl—)>c(NH4+)D.c(H+)>c(Cl—)>c(NH4+)>c(OH—)