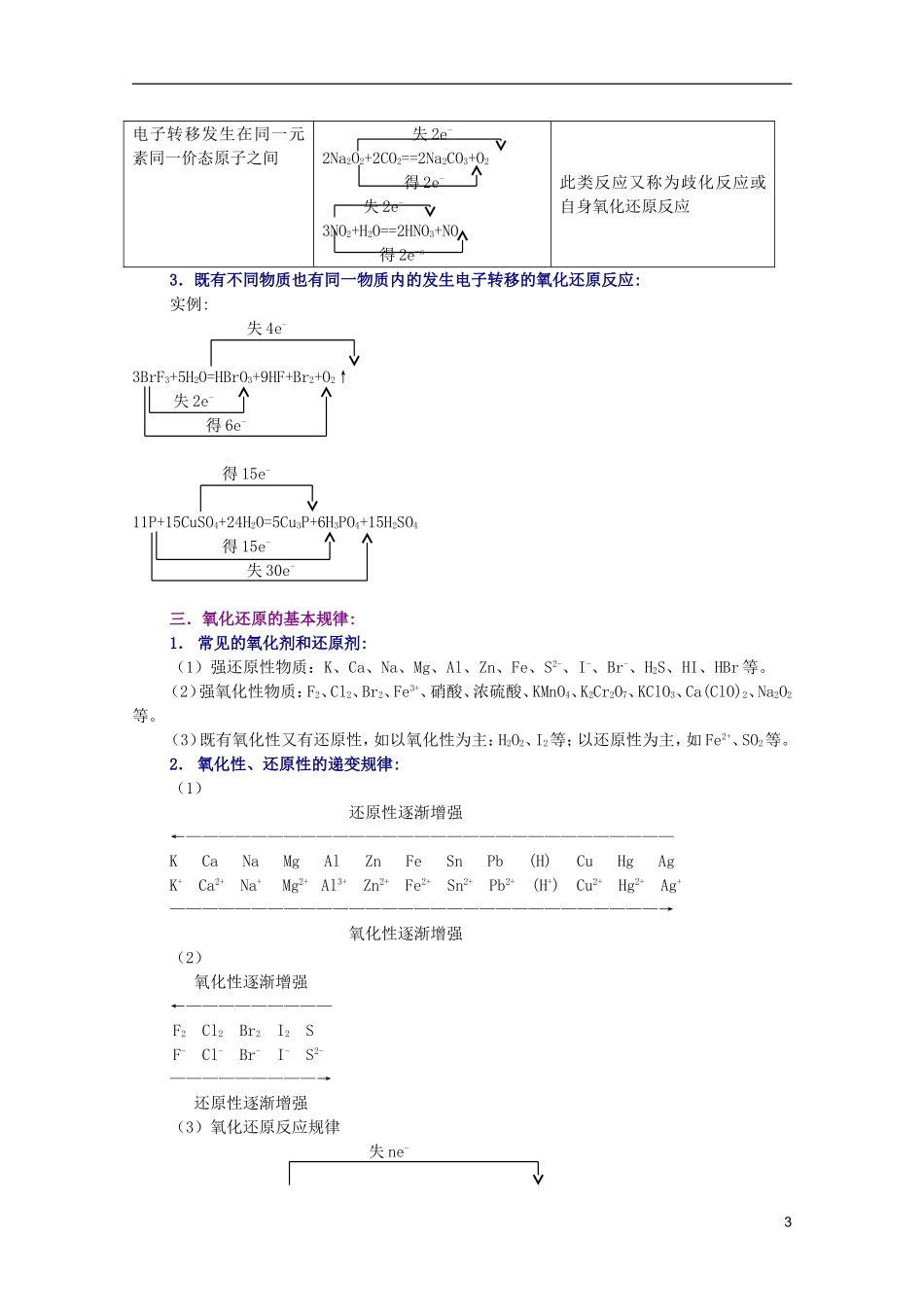
氧化还原反应复习网上课堂[本讲主要内容]1.氧化还原反应的基础知识2.氧化还原反应的基本类型3.氧化还原反应的基本规律4.氧化还原反应方程式配平的方法5.氧化还原反应的应用[学习指导和例题]一.氧化还原反应的基础知识:1.氧化还原反应的概念:(1)得失氧观点:凡有得失氧的反应都是氧化还原反应。(2)化合价升降观点:凡有元素化合价发生变化的反应都是氧化还原反应。(3)电子转移的观点:凡有电子转移(包括电子得失或电子对偏移)的反应都是氧化还原反应。其中,化合价升降观点表明了氧化还原反应的特征,电子转移观点则揭示了氧化还原反应的本质。2.几对基本概念的联系与区别:(1)氧化反应与还原反应(2)氧化剂与还原剂(3)氧化产物与还原产物(4)氧化性与还原性各概念的关系可表示如下:氧化剂(具有氧化性)+ne-还原产物(表现为化合价降低)还原剂(具有还原性)-ne-氧化产物(表现为化合价升高)3.氧化还原反应与四种基本反应类型的关系:4.氧化还原反应中电子转移的表示法:(1)单线桥法:2e-Zn+CuSO4==ZnSO4+Cu(2)双线桥法:失2e-MnO2+4HClMnCl2+Cl2↑+2H2O得2e-比较:单线桥的箭头表示还原剂(Zn)与氧化剂(CuSO4)间的电子转移关系,“2e-”表示转1移电子的数目,“2e-”前不用再写“得”或“失”等字。而双线桥的箭头不是表明电子的直接转移关系,而是表明同一种元素在反应前后的电子得失情况。氧化剂箭头所指向的产物为还原产物,还原剂箭头所指向的产物为氧化产物。在“2e-”前必须注明“失”或“得”字,或者是“+”或“-”符号。二.氧化——还原反应的基本类型:1.不同物质(包括分子,原子和离子)间发生电子转移的氧化还原反应。单质阳离子阴离子化合物(分子)单质2H2+O22H2O2Fe+3Cl22FeCl32Al+3SAl2S3Zn+Cu2+=Zn2++CuCu+2Fe3+=2Fe2++Cu2+Fe+2Fe3+=3Fe2+3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O2Na+2H2O=2NaOH+H2↑Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O阳离子2Fe2++Cl2==2Fe3++2Cl-4Fe2++O2+4H+=4Fe3++2H2OSn2++2Fe3+=Sn4++2Fe2+3Fe2++4H++NO3-=3Fe3++NO↑+2H2O2Fe2++H2O2+2H+=2Fe3++2H2O阴离子2I-+Br2=I2+2Br-SO32-+Cl2+H2O=SO42-+2H++2Cl-2I-+2Fe3+=I2+2Fe2+SO32-+H2O+2Fe3+=SO42-+2H++2Fe2+6I-+2NO3-+8H+=3I2+2NO↑+4H2O5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O2I-+H2O2+2H+=I2+2H2OSO32-+H2O2=SO42-+H2O化合物(分子)2H2S+3O22SO2+2H2O4Fe(OH)2+O2+2H2O=4Fe(OH)32NH3+3Cl2=N2+6HClH2S+2Fe3+=2Fe2++S↓+2H+SO2+2H2O+2Fe3+=SO42-+4H++2Fe2+5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O3H2S+2NO3-+2H+=3S↓+2NO↑+4H2O2H2S+SO2=3S+2H2OSO2+NO2=SO3+NO2.物质分子或晶体内部发生电子转移的氧化还原反应:反应类型实例备注电子转移发生在同一物质不同元素原子之间12e-2KClO32KCl+3O2↑4e-4HNO34NO2↑+O2↑+2H2O多数反应属于分解反应电子转移发生在同一物质同一元素不同价态原子之间4e-NH4NO3==N2O+2H2O失15e-5NH4NO34N2+2HNO3+9H2O得15e-无单质生成的分解反应也有可能是氧化还原反应2电子转移发生在同一元素同一价态原子之间失2e-2Na2O2+2CO2==2Na2CO3+O2得2e-失2e-3NO2+H2O==2HNO3+NO得2e-s此类反应又称为歧化反应或自身氧化还原反应3.既有不同物质也有同一物质内的发生电子转移的氧化还原反应:实例:失4e-3BrF3+5H2O=HBrO3+9HF+Br2+O2↑失2e-得6e-得15e-11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4得15e-失30e-三.氧化还原的基本规律:1.常见的氧化剂和还原剂:(1)强还原性物质:K、Ca、Na、Mg、Al、Zn、Fe、S2-、I-、Br-、H2S、HI、HBr等。(2)强氧化性物质:F2、Cl2、Br2、Fe3+、硝酸、浓硫酸、KMnO4、K2Cr2O7、KClO3、Ca(ClO)2、Na2O2等。(3)既有氧化性又有还原性,如以氧化性为主:H2O2、I2等;以还原性为主,如Fe2+、SO2等。2.氧化性、还原性的递变规律:(1)还原性逐渐增强←——————————————————————————————KCaNaMgAlZnFeSnPb(H)CuHgAgK+Ca2+Na+Mg2+Al3+Zn2+Fe2+Sn2+Pb2+(H+)Cu2+Hg2+Ag+——————————————————————————————→氧化性逐渐增强(2)氧化性逐渐增强←—————————F2Cl2Br2I2SF-Cl-Br-...