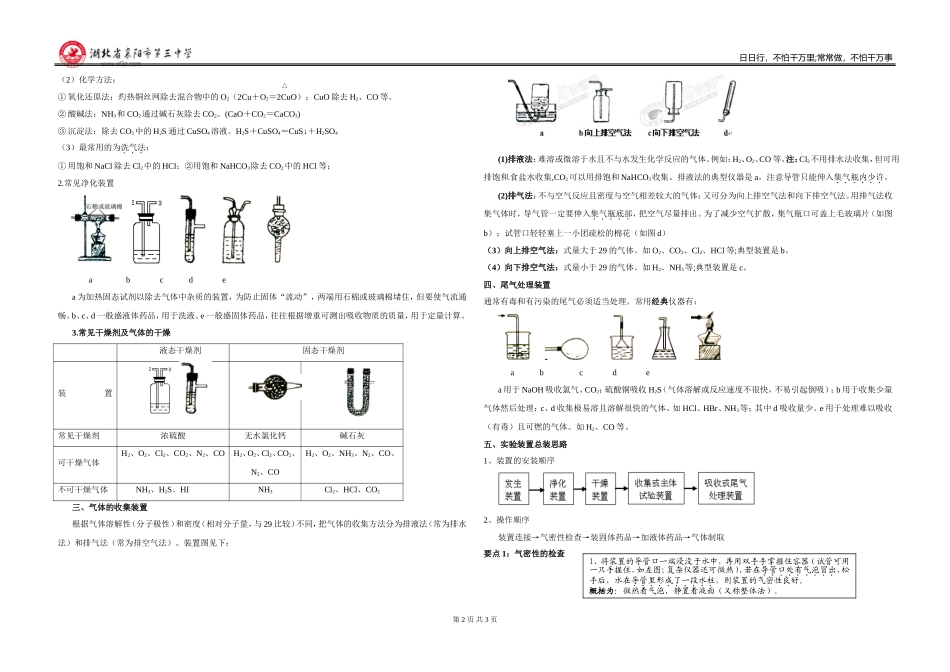
第1页共3页日日行,不怕千万里;常常做,不怕千万事2020~2021学年高一年级化学学科学案编者:段娟审核人:段娟日期:2020.10.23常见气体的制备常见气体的制备除掌握常见气体和典型有机物的制备方法外。做其它综合制备题时,思路往往是逆向的。几种常见气体的反应原理见下表1O22KClO3MnO22KCl+3O2↑2KMnO4K2MnO4+MnO2+O2↑2H2Zn+H2SO4(稀)=ZnSO4+H2↑3CO2CaCO3+2HCl=CaCl2+CO2↑+H2O4Cl2MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O5HClNaCl(固)+H2SO4(浓)微热NaHSO4+HCl↑一、气体装置的类型及选择1.固+固(加热):适用于制O2注意事项:l、试管口应稍向下倾斜,以防止产生的水蒸气在管口冷却后倒流而引起试管破裂。2、铁夹应夹在距管口l/3处。3、固体药品要放在试管底部平铺开,加热时首先均匀预热,然后在试管的最后部位集中加热。4、胶塞上的导管伸入试管里不能过长,否则会妨碍气体导出。5、如用排气法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯。以防止水倒流。6、用KMnO4制取O2时,为了防止生成的细小颗粒堵塞导管,在大试管口放一松软棉花。2.固+液体(不加热):适用于制CO2、H2(1)常规类注意事项:1.瓶内气密性要好。2.先放固体后加液体。(为什么?)3.加人酸的量要适当。4.生成气体微溶或难溶于水。(2)启普发生器类注意事项:1.在简易装置中长颈漏斗的下口应深入液面以下,否则起不到液封的作用而无法使用。2.加入大小适宜不溶于水的块状固体,如果太碎会落入底部的酸中使反应无法控制。造成容器内压力过大,导致酸液溢出。3.加人酸的量要适当。4.在导管口点燃氢气或其它可燃性气体时,必须先检验纯度。(3)固+液或液+液(加热):适用于制Cl2、(HCl课本没有)abcdef注意事项:l、瓶内反应物体积不宜超过烧瓶容积的1/3。2、a、b、c加热前应放入碎瓷片,防止暴沸。3、a装置温度计插入反应液面以下,测反应液温度;b装置温度计水银球与支管端口处相平,测气体温度,便于控制馏份。4、d装置便于随时加入液体,但随反应进行烧瓶内压强增加,液体不易滴入。(改进方法见e)二、气体的净化(干燥)装置1.常见净化原理:气体的净化可分为物理方法和化学方法。遵循以下原理:A.不损失主体气体;B.不引入新杂质;C在密闭容器中进行;D.先除易除的气体。(1)物理方法:①液化法:利用沸点不同从空气中分离N2和O2。②水洗法:利用溶解度不同从N2和NH3中除去NH3。第2页共3页△日日行,不怕千万里;常常做,不怕千万事(2)化学方法:①氧化还原法:灼热铜丝网除去混合物中的O2(2Cu+O2=2CuO);CuO除去H2、CO等。②酸碱法:NH3和CO2通过碱石灰除去CO2。(CaO+CO2=CaCO3)③沉淀法:除去CO2中的H2S通过CuSO4溶液。H2S+CuSO4=CuS↓+H2SO4(3)最常用的为洗气法:①用饱和NaCl除去Cl2中的HCl;②用饱和NaHCO3除去CO2中的HCl等;2.常见净化装置abcdea为加热固态试剂以除去气体中杂质的装置,为防止固体“流动”,两端用石棉或玻璃棉堵住,但要使气流通畅。b、c、d一般盛液体药品,用于洗液。e一般盛固体药品,往往根据增重可测出吸收物质的质量,用于定量计算。3.常见干燥剂及气体的干燥液态干燥剂固态干燥剂装置常见干燥剂浓硫酸无水氯化钙碱石灰可干燥气体H2、O2、Cl2、CO2、N2、COH2、O2、Cl2、CO2、N2、COH2、O2、NH3、N2、CO、不可干燥气体NH3、H2S、HINH3Cl2、HCl、CO2三、气体的收集装置根据气体溶解性(分子极性)和密度(相对分子量,与29比较)不同,把气体的收集方法分为排液法(常为排水法)和排气法(常为排空气法)。装置图见下:(1)排液法:难溶或微溶于水且不与水发生化学反应的气体。例如:H2、O2、CO等。注:Cl2不用排水法收集,但可用排饱和食盐水收集,CO2可以用排饱和NaHCO3收集。排液法的典型仪器是a,注意导管只能伸入集气瓶内少许。(2)排气法:不与空气反应且密度与空气相差较大的气体;又可分为向上排空气法和向下排空气法。用排气法收集气体时,导气管一定要伸入集气瓶底部,把空气尽量排出。为了减少空气扩散,集气瓶口可盖上毛玻璃片(如图b);试管口轻轻塞上一小团疏松的棉花(如图d)(3)向上排空气法:式量...