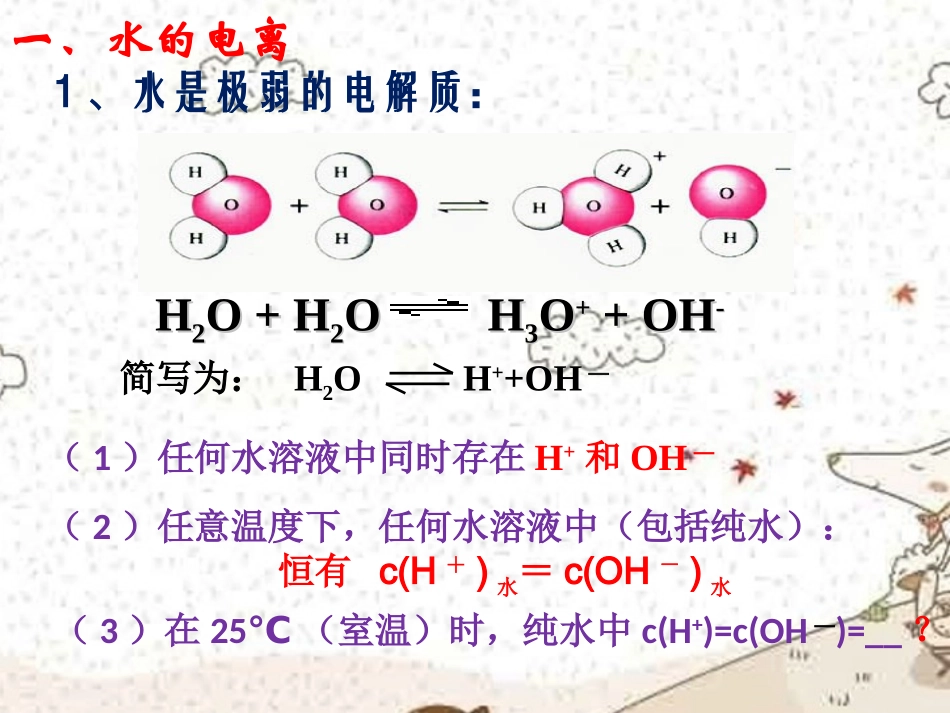
第2讲水的电离和溶液的酸碱性(天津)25℃时,水的电离达到平衡:H2OH++OH-;H>0,下列叙述正确的是()A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低B、向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变C、向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低D、将水加热,KW增大,pH不变B一、水的电离1、水是极弱的电解质:HH22O+HO+H22OHOH33OO+++OH+OH--简写为:H2OH++OH―(1)任何水溶液中同时存在H+和OH―(2)任意温度下,任何水溶液中(包括纯水):恒有c(H+)水=c(OH-)水(3)在25℃(室温)时,纯水中c(H+)=c(OH―)=__?一、水的电离2、水的离子积常数:在一定温度下,c(H+)与c(OH―)的乘积是一个常数,称为水的离子积常数,简称水的离子积,用符号Kw表示,即Kw=c(H+)·c(OH―)(1)Kw不仅适用于纯水中,而且适用于任何水溶液:在酸溶液中:Kw=c(H+)酸·c(OH―)水在碱溶液中:Kw=c(H+)水·c(OH―)碱在纯水和盐溶液中:Kw=c(H+)水·c(OH―)水(2)Kw只受温度影响,常温时(25℃)Kw=1×10-14,温度升高,水的电离程度增大。Kw亦增大,100℃,Kw=1×10-12。H2OH++OH-△H>0条件变化移动方向c(H+)c(OH-)Kw升高温度加盐酸加NaOH溶液加FeCl3溶液加Na2CO3溶液加活泼的金属Na正向增大增大逆向增大减小逆向减小增大正向增大减小正向减小增大正向减小增大增大不变不变不变不变不变一、水的电离3、影响水的电离平衡因素:H2OH++OH-△H>0一、水的电离3、影响水的电离平衡因素:(1)温度:越热越电离(2)加酸或碱:抑制(3)加正盐:①强酸强碱盐:不影响,如NaCl②能水解的盐:促进,如Na2CO3(4)加酸式盐:①以电离为主:抑制,如NaHSO4、NaHSO3②以水解为主:促进,如NaHCO3(5)加活泼金属:促进1、25℃,在pH=3的盐酸溶液中,c(H+)=,c(OH-)=,c(H+)水=,c(OH-)水=_______;25℃,在pH=11的NaOH溶液中,c(H+)=,c(OH-)=,c(H+)水=,c(OH-)水=_______;想一想:2、25℃,在pH=4的AgNO3溶液中,c(H+)水=,c(OH-)水=______;25℃,在pH=10的Na2CO3的溶液中,c(H+)水=,c(OH-)水=______;10-3mol·L-110-11mol·L-110-11mol·L-110-11mol·L-110-11mol·L-110-3mol·L-110-11mol·L-110-11mol·L-110-4mol·L-110-4mol·L-110-4mol·L-110-4mol·L-1【例1】某温度下纯水中c(H+)=2×10-7mol·L-1,则此时c(OH-)=;该温度下向纯水中滴加盐酸使c(H+)=5×10-6mol·L-1,则此时c(OH-)=。【例2】94上海下列四种溶液中,由水电离生成的氢离子浓度之比①∶②∶③∶④是①pH=0的盐酸②01mol/L的盐酸③001mol/L的NaOH溶液④pH=11的NaOH溶液A、1∶10∶100∶1000B、0∶1∶12∶11C、14∶13∶12∶11D、14∶13∶2∶3A二、溶液的酸碱性与pH1、溶液的酸碱性:(1)本质:由溶液中c(H+)、c(OH-)相对大小决定的:c(H+)>c(OH-),溶液呈;c(H+)=c(OH-),溶液呈;c(H+)