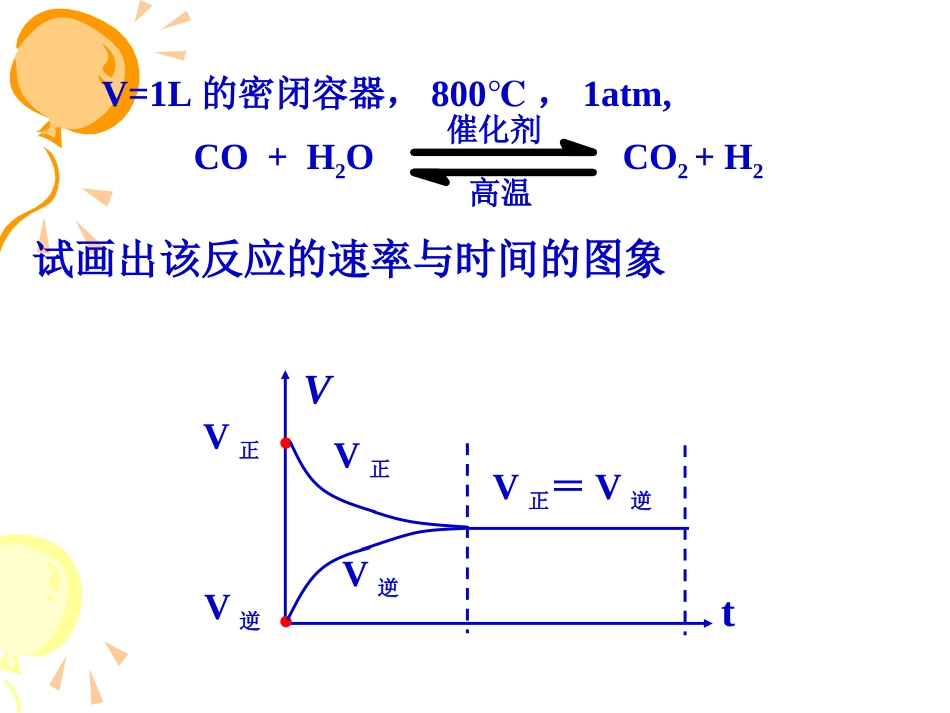
第二章化学反应速率和化学平衡第三节化学平衡一、可逆反应在同一条件下,既能向正反应方向进行同时又能向逆反应方向进行的反应特点:同一条件、同时进行、反应物生成物同时存在(反应不能进行到底)V=1L的密闭容器,800℃,1atm,CO+H2OCO2+H2催化剂高温试画出该反应的速率与时间的图象Vt●V正●V逆V正V逆V正=V逆二、化学平衡状态1、化学平衡状态指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。①前提条件:一定条件(恒温恒压或恒温恒容)②研究对象:密闭容器的可逆反应③平衡本质:V正=V逆≠0④平衡标志:各物质的浓度不变2、化学平衡的特征③动:动态平衡②等:V正=V逆≠0④定:反应条件一定,反应混合物中各组分的浓度一定⑤变:条件改变,平衡将被破坏。①逆:可逆反应①同一种物质:该物质的生成速率等于它的消耗速率。②不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。化学平衡状态的标志:(1)等速标志,υ正=υ逆(本质特征)(2)恒浓标志,反应混合物中各组成成分的浓度保持不变(外部表现):①各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。②各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。③若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。④反应物的转化率、产物的产率保持不变。在一定温度下,反应X2(g)+Y2(g)2XY(g)达到平衡的标志是⑴单位时间内同时生成nmolX2和nmolXY⑵单位时间内生成2nmolXY的同时生成nmolY2⑶容器内总压强不随时间变化⑷单位时间内有nmolX—X键断裂,同时有nmolY—Y键断裂⑸单位时间内生成nmolX2同时生成nmolY2⑹V正=V逆=0在一定温度下,反应X2(g)+Y2(g)2XY(g)达到平衡的标志是⑺X2、Y2或XY的浓度不再随时间的改变而改变⑻容器中X2、Y2、XY物质的量之比为112∶∶⑼X2、Y2的物质的量浓度相等⑽容器中气体的总质量不随时间的改变而改变⑾若只有X2有颜色,容器中的颜色不随时间的改变而改变项目mA(g)+nB(g)pC(g)+qD(g)是否平衡混合体系中各组分的含量各物质的物质的量或物质的量的分数一定平衡各物质的质量或质量分数一定平衡各气体的体积或体积分数一定平衡总压强、总体积、总物质的量一定不一定mA(g)+nB(g)pC(g)+qD(g)是否平衡正、逆反应速率关系在单位时间内消耗了mmolA的同时生成了mmolA平衡在单位时间内消耗了nmolB的同时消耗了pmolC平衡在单位时间内生成了nmolB的同时消耗了qmolD(均指ひ逆)不一定ひ(A)׃ひ(B)׃ひ(C)׃ひ(D)==m׃n׃p׃q,ひ正不一定等于ひ逆不一定mA(g)+nB(g)pC(g)+qD(g)是否平衡压强当m+n≠p+q时,总压力一定(其它条件一定)平衡当m+n=p+q时,总压力一定(其它条件一定)不一定混合气体的平均M当m+n≠p+q时,M一定平衡当m+n=p+q时,M一定不一定注意化学反应的特点密度ρC(s)+CO2(g)2CO(g)(ρ一定)平衡N2(g)+3H2(g)2NH3(g)(ρ一定)不一定H2(g)+I2(g)2HI(g)(ρ一定)不一定第三节化学平衡(第二课时)条件改变建立新平衡破坏旧平衡平衡2V正=V逆≠0′′一定时间【新授】V正=V逆≠0平衡1V正≠V逆′′不平衡化学平衡的移动中学学科网2、移动原因:3、移动方向:若v(正)>v(逆),平衡向正反应方向移动若v(逆)>v(正),平衡向逆反应方向移动若v(正)=v(逆),平衡不移动可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。三、化学平衡的移动1、定义:条件改变,使V正≠V逆巧记:化学平衡总往反应速率大的方向移动。(1)、浓度对化学平衡的影响4、影响化学平衡移动的因素:学生实验1:中学学科网Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+已知在K2Cr2O7的溶液中存在着如下平衡:实验步骤:①取两支试管各加入2mL0.1mol/LK2Cr2O7溶液,(2mL约两滴管)②在一支试管中滴加3~10滴浓H2SO4,观察溶液颜色的变化。③在另一支试管中滴加10~20滴6mol/LNaOH,观察溶液颜色的变化。Cr2O72-+H2O2CrO42-+2H+橙色黄色滴加3~10滴浓H2SO4滴加10~20滴6mol/LNaOH...