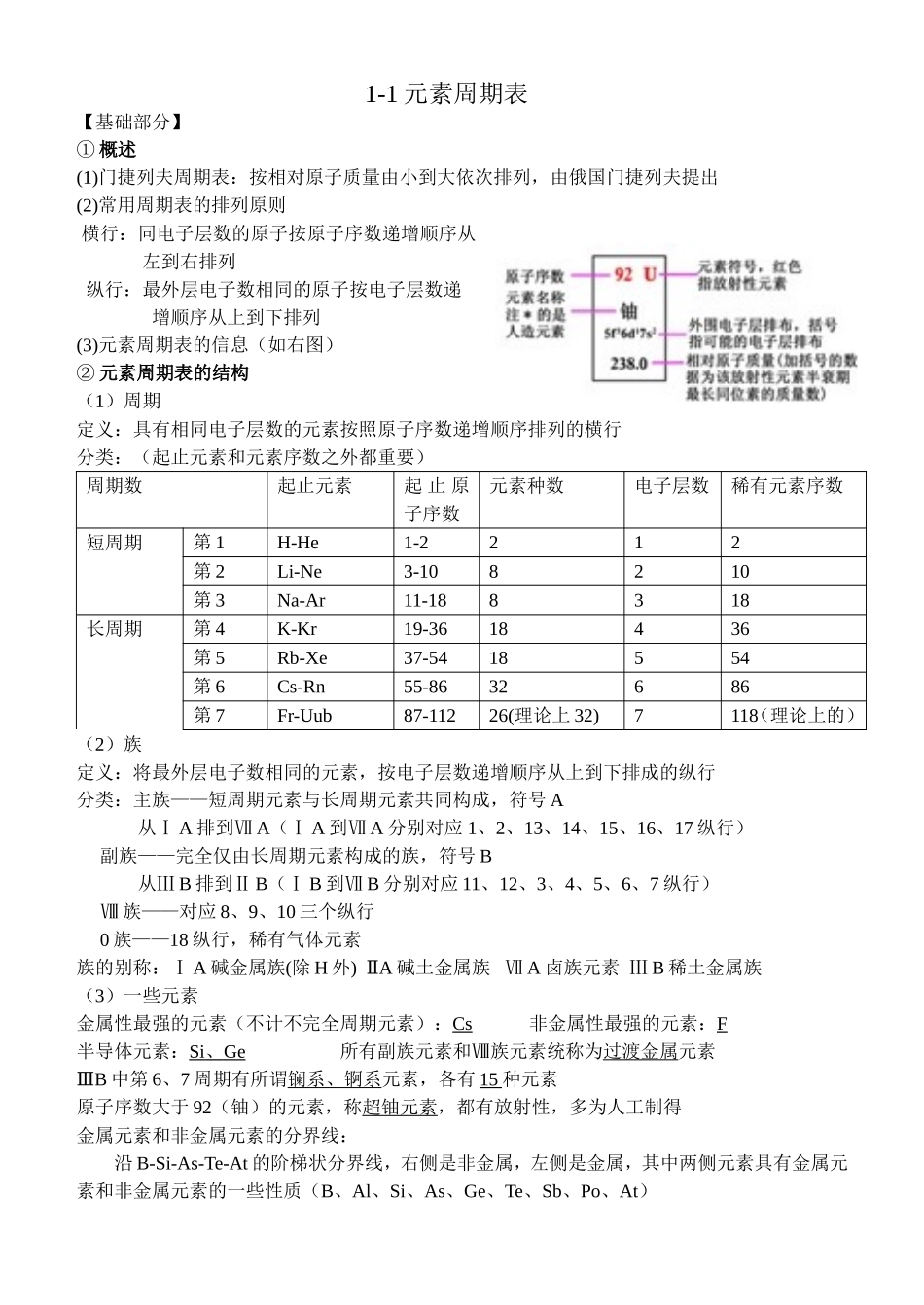
1-1元素周期表【基础部分】①概述(1)门捷列夫周期表:按相对原子质量由小到大依次排列,由俄国门捷列夫提出(2)常用周期表的排列原则横行:同电子层数的原子按原子序数递增顺序从左到右排列纵行:最外层电子数相同的原子按电子层数递增顺序从上到下排列(3)元素周期表的信息(如右图)②元素周期表的结构(1)周期定义:具有相同电子层数的元素按照原子序数递增顺序排列的横行分类:(起止元素和元素序数之外都重要)周期数起止元素起止原子序数元素种数电子层数稀有元素序数短周期第1H-He1-2212第2Li-Ne3-108210第3Na-Ar11-188318长周期第4K-Kr19-3618436第5Rb-Xe37-5418554第6Cs-Rn55-8632686第7Fr-Uub87-11226(理论上32)7118(理论上的)(2)族定义:将最外层电子数相同的元素,按电子层数递增顺序从上到下排成的纵行分类:主族——短周期元素与长周期元素共同构成,符号A从ⅠA排到ⅦA(ⅠA到ⅦA分别对应1、2、13、14、15、16、17纵行)副族——完全仅由长周期元素构成的族,符号B从ⅢB排到ⅡB(ⅠB到ⅦB分别对应11、12、3、4、5、6、7纵行)Ⅷ族——对应8、9、10三个纵行0族——18纵行,稀有气体元素族的别称:ⅠA碱金属族(除H外)ⅡA碱土金属族ⅦA卤族元素ⅢB稀土金属族(3)一些元素金属性最强的元素(不计不完全周期元素):Cs非金属性最强的元素:F半导体元素:Si、Ge所有副族元素和Ⅷ族元素统称为过渡金属元素ⅢB中第6、7周期有所谓镧系、锕系元素,各有15种元素原子序数大于92(铀)的元素,称超铀元素,都有放射性,多为人工制得金属元素和非金属元素的分界线:沿B-Si-As-Te-At的阶梯状分界线,右侧是非金属,左侧是金属,其中两侧元素具有金属元素和非金属元素的一些性质(B、Al、Si、As、Ge、Te、Sb、Po、At)(4)一些关系:周期序数=电子层数主族序数=原子最外层电子数=元素最高正化合价数原子序数=核电荷数=质子数=原子核外电子数③元素的性质与原子结构(1)碱金属元素(Li、Na、K、Rb、Cs、Fr)1.随着核电荷数增大,电子层数逐渐增加,原子半径增大;碱金属元素原子最外层电子数都是12.Na、K与O2、H2O的反应Na:与O2→剧烈燃烧,黄色火焰与H2O→熔成小球,浮于水面,四处游动,发出嘶声K:与O2→更剧烈燃烧,紫色火焰与H2O→熔成小球,浮于水面,四处游动,发出轻微爆炸声结论:K比Na活泼注意点:ⅠNa、K易与O2和H2O反应,实验室中Na、K都保存在煤油中Ⅱ实验时必须用滤纸擦净表面煤油,用小刀切取后立即投入水中Ⅲ用于加热的坩埚必须干燥,因为Na、K都会与水反应ⅣNa、K与水反应剧烈,一般Na取黄豆大小,K取绿豆太小,如果过大有发生火灾、爆炸的危险,过小则产生气体量太小,不易检验生成气体3.化学性质:①相似性:易失去最外层的单电子,化学性质活泼,都能与O2等非金属单质反应关于Li、Na、K的氧化物:Li—Li2O,Na—Na2O、Na2O2,K—K2O、K2O2、KO2②差异性:核电荷数增加→原子层数增多→原子核对最外层电子引力逐渐减弱→从Li到Cs金属性(金属元素原子失电子的能力)增强、单质还原性增强,与水反应更容易,与氧反应更容易且生成产物更复杂4.物理性质:硬度小、密度小、熔点低、沸点低,除Cs略带金色光泽外,其余均为银白色,均较柔软(可以用小刀切割),从Li到Cs熔点、沸点下降,密度增大(但K的密度小于Na的密度),与其他金属单质一样都有延展性,有良导电、导热性(液态Na可作核反应堆传热介质)(2)卤素元素(F、Cl、Br、I、At)1.原子结构:同—最外层有7电子,异—随核电荷数增加,电子层数增加,半径增大2.物理性质:从F到I,颜色由浅到深(淡黄绿—黄绿—深红棕—紫黑),密度由小到大,熔沸点从低到高(常温下气体—气体—液体—固体),溶于水,更易溶于有机溶剂溴碘溶解于各种溶剂后颜色变化如下水苯/汽油(与水混合在上层)四氯化碳(与水混合在下层)Br2橙橙→橙红橙→橙红I2深黄→褐淡紫→紫红紫→深紫3.化学性质①与H2:F2在暗处反应,产物很稳定(HF);Cl2光照或者点燃,产物较稳定(HCl);Br2加热,产物不稳定(HBr);I2不断加热,产物不稳定(HI),是可逆反应。②与水:2F2+2H2O=4HF+O2↑,X2+H2O=HX+HXO(X=Cl、Br、I)③与碱:X...