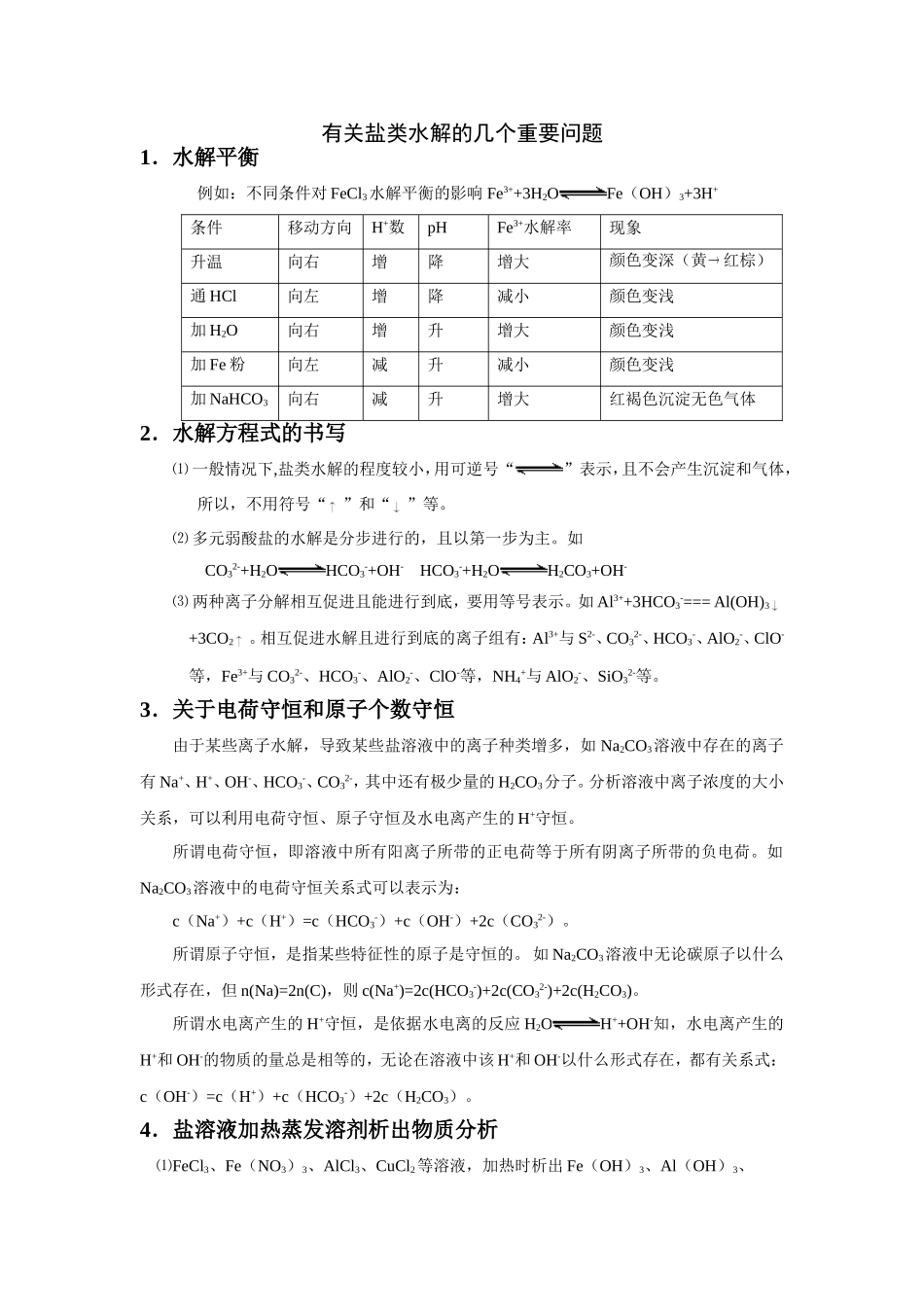
有关盐类水解的几个重要问题1.水解平衡例如:不同条件对FeCl3水解平衡的影响Fe3++3H2OFe(OH)3+3H+条件移动方向H+数pHFe3+水解率现象升温向右增降增大颜色变深(黄红棕)通HCl向左增降减小颜色变浅加H2O向右增升增大颜色变浅加Fe粉向左减升减小颜色变浅加NaHCO3向右减升增大红褐色沉淀无色气体2.水解方程式的书写⑴一般情况下,盐类水解的程度较小,用可逆号“”表示,且不会产生沉淀和气体,所以,不用符号“”和“”等。⑵多元弱酸盐的水解是分步进行的,且以第一步为主。如CO32-+H2OHCO3-+OH-HCO3-+H2OH2CO3+OH-⑶两种离子分解相互促进且能进行到底,要用等号表示。如Al3++3HCO3-===Al(OH)3+3CO2。相互促进水解且进行到底的离子组有:Al3+与S2-、CO32-、HCO3-、AlO2-、ClO-等,Fe3+与CO32-、HCO3-、AlO2-、ClO-等,NH4+与AlO2-、SiO32-等。3.关于电荷守恒和原子个数守恒由于某些离子水解,导致某些盐溶液中的离子种类增多,如Na2CO3溶液中存在的离子有Na+、H+、OH-、HCO3-、CO32-,其中还有极少量的H2CO3分子。分析溶液中离子浓度的大小关系,可以利用电荷守恒、原子守恒及水电离产生的H+守恒。所谓电荷守恒,即溶液中所有阳离子所带的正电荷等于所有阴离子所带的负电荷。如Na2CO3溶液中的电荷守恒关系式可以表示为:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)。所谓原子守恒,是指某些特征性的原子是守恒的。如Na2CO3溶液中无论碳原子以什么形式存在,但n(Na)=2n(C),则c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3)。所谓水电离产生的H+守恒,是依据水电离的反应H2OH++OH-知,水电离产生的H+和OH-的物质的量总是相等的,无论在溶液中该H+和OH-以什么形式存在,都有关系式:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。4.盐溶液加热蒸发溶剂析出物质分析⑴FeCl3、Fe(NO3)3、AlCl3、CuCl2等溶液,加热时析出Fe(OH)3、Al(OH)3、Cu(OH)2。蒸干后再加热析出物又会分解。如:AlCl3+3H2OAl(OH)3+3HCl2Al(OH3)Al2O3+3H2O⑵CuSO4、Na2CO3等溶液,加热时分别析出结晶水合物CuSO4·5H2O、Na2CO3·10H2O。再加热析出物又分解。如CuSO4+5H2OCuSO4·5H2OCuSO4·5H2OCuSO4+5H2OCuSO4CuO+SO3但Na2CO3一般不易分解。⑶Mg(HCO3)2、Ca(HCO3)2等溶液、加热时析出MgCO3、CaCO3等固体。如Mg(HCO3)2MgCO3+CO2+H2OMgCO3+H2OMg(OH2)+CO2再加热(高温)其固体则产物又受热分解:Mg(OH)2MgO+H2OCaCO3CaO+CO2⑷KHCO3、NaHCO3、KNO3等溶液,加热其盐析出,该盐加热又分解。如:2NaHCO3Na2CO3+CO2+H2O2KNO32KNO3+O2