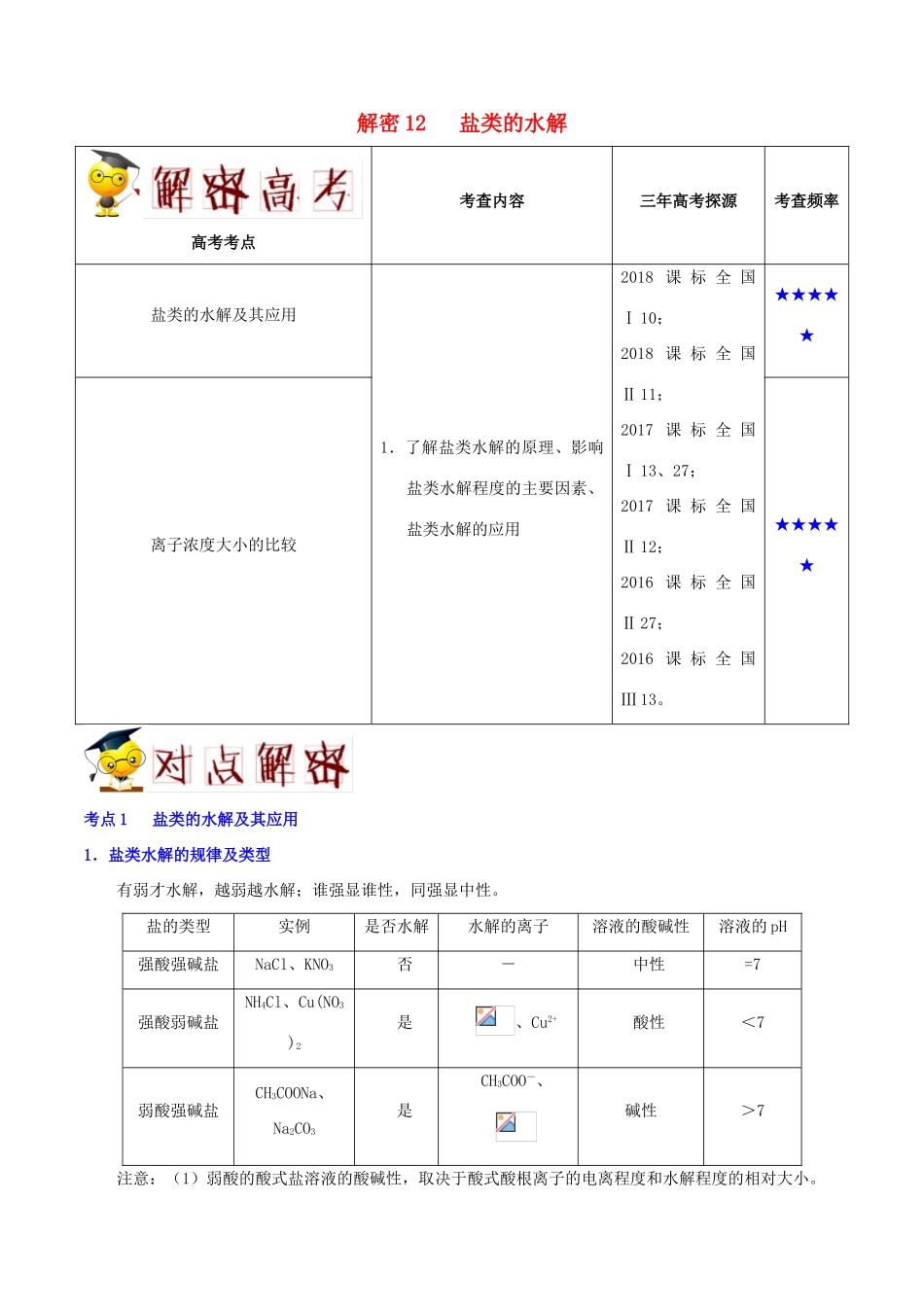
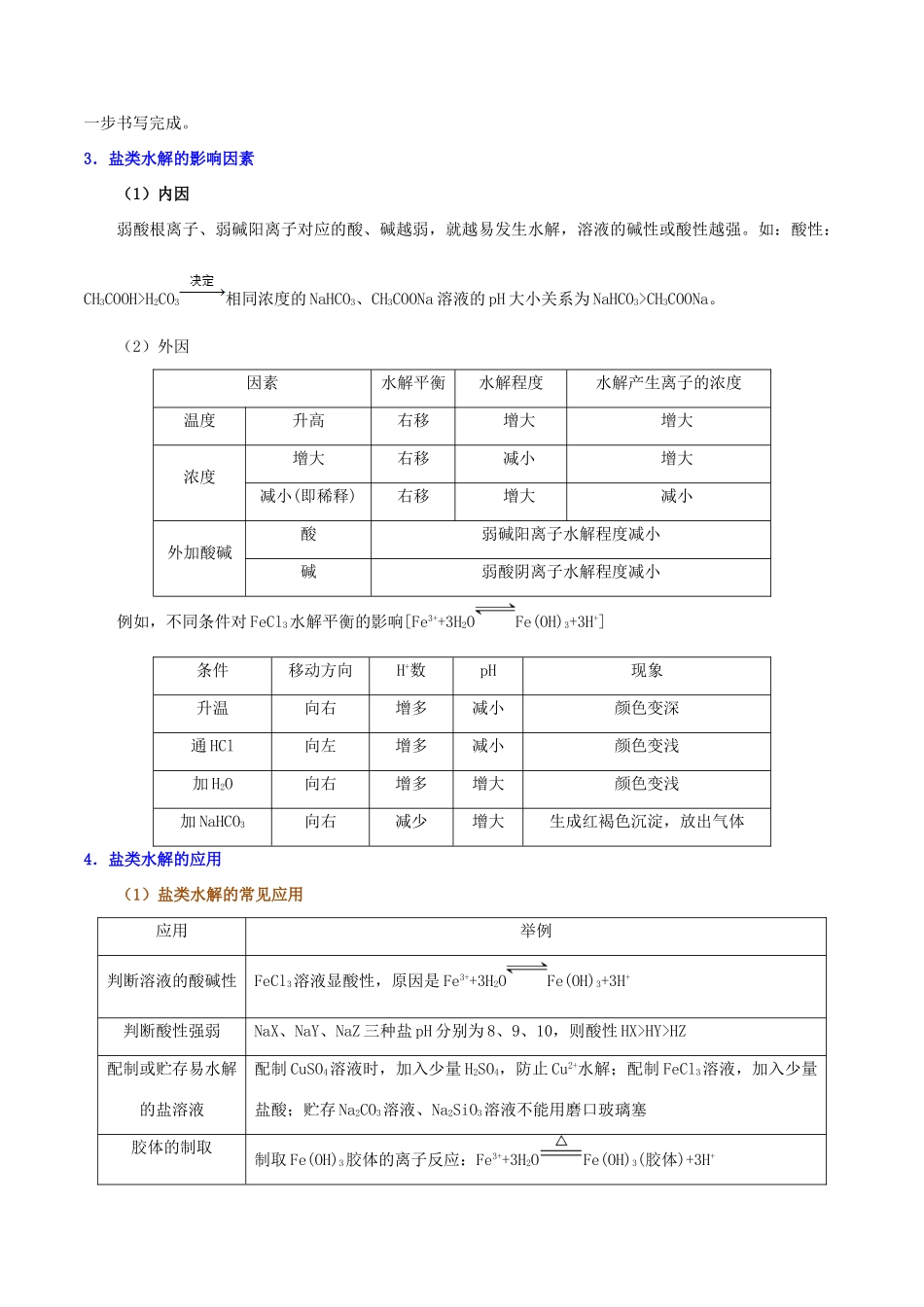
解密 12 盐类的水解高考考点考查内容三年高考探源考查频率盐类的水解及其应用1.了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用2018 课 标 全 国Ⅰ 10;2018 课 标 全 国Ⅱ 11;2017 课 标 全 国Ⅰ 13、27;2017 课 标 全 国Ⅱ 12;2016 课 标 全 国Ⅱ 27;2016 课 标 全 国Ⅲ 13。★★★★★离子浓度大小的比较★★★★★考点 1 盐类的水解及其应用1.盐类水解的规律及类型有弱才水解,越弱越水解;谁强显谁性,同强显中性。盐的类型实例是否水解水解的离子溶液的酸碱性溶液的 pH强酸强碱盐NaCl、KNO3否-中性=7强酸弱碱盐NH4Cl、Cu(NO3)2是、Cu2+酸性<7弱酸强碱盐CH3COONa、Na2CO3是CH3COO-、碱性>7注意:(1)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。① 若电离程度小于水解程度,溶液显碱性。如 NaHCO3溶液中:H++(次要),+H2OH2CO3+OH-(主要)。② 若电离程度大于水解程度,溶液显酸性。如 NaHSO3溶液中:HSOH++SO(主要),HSO+H2OH2SO3+OH-(次要)。(3)相同条件下的水解程度:正盐>相应酸式盐,如>。(4)相互促进水解的盐>单独水解的盐>水解相互抑制的盐。如的水解:(NH4)2CO3>(NH4)2SO4>(NH4)2Fe(SO4)2。2.盐类水解方程式的书写(1)一般情况下盐类水解的程度较小,应用“”连接反应物和生成物。水解生成的难溶性或挥发性物质不加“↓”或“↑”符号。如 Cu2++2H2OCu(OH)2+2H+,HS−+H2OH2S+OH−。(2)多元弱酸阴离子分步水解,应分步书写水解的离子方程式。因为第一步水解程度较大,一般只写第一步水解的方程式。如 Na2CO3 的水解分两步,第一步为+H2O+OH−,第二步为+H2OH2CO3+OH−。多元弱碱阳离子的水解方程式不要求分步书写。如 AlCl3的水解方程式为 Al3++3H2OAl(OH)3+3H+。(3)发生相互促进的水解反应时,由于能水解彻底,用“”连接反应物和生成物,水解生成的难溶性或挥发性物质要写 “↓”或“↑”符号。如 FeCl3与 NaHCO3溶液混合发生水解的离子方程式为 Fe3++3Fe(OH)3↓+3CO2↑。(4)盐类水解的离子方程式可用通式表示为 R−+H2OHR+OH−,Rm−+H2OHR(m1)−−+OH−(分步水解);R++H2OROH+H+,Rn++nH2OR(OH)n+nH+(“一步到位”)。注意:(1)一般情况下盐类水解程度较小,是可逆反应,因此用可逆号“”表示水解程度。当水解趋于完全时,才用“”。(2)水解反应生成的挥发性物质及难溶物不...