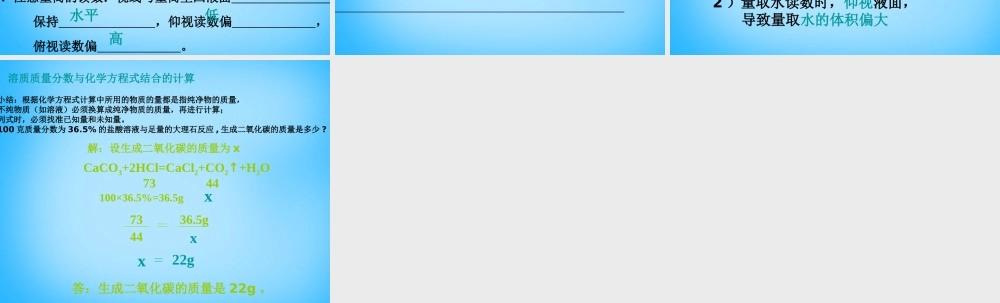
一定溶质质量分数的溶液的配制 一、回顾已知,引入新课 溶质的质量分数=×l00% =×l00%溶液质量=溶质质量+溶剂质量 =溶液的密度 × 溶液体积溶质质量= × 溶剂质量= - 溶质质量溶液质量溶质质量溶质质量 + 溶剂质量溶质的质量分数溶液质量溶质质量溶液质量实验 配制 50g 质量分数为 6 %的氯化钠溶液。1 计算:配制 50g 质量分数为 6 %的氯化钠溶液所需 氯化钠和水的质量分别为:氯化钠 g , 水 g 。2 .称量:用托盘天平称量所需的氯化钠,倒人烧杯中。3 .量取:用量筒量取所需的水 ( 把水的密度看成 1g/cm3) , 倒入盛有氯化钠的烧杯里4 .溶解:用玻璃棒搅拌,使氯化钠溶解。二、自主学习 一)溶液的配制50×6%=350 - 3=47实验二 配制质量分数为 3 %的氯化钠溶液。用已配好的质量分数为 6 %的氯化钠溶液(密度约为 1.04 g / cm3 ),配制 50g 质量分数为 3 %的氯化钠溶液。1 .计算:配制 50g 质量分数为 3 %的氯化钠溶液所需 6 %氯化钠 溶液和水的质量分别为 6 %氯化钠溶液 g (体积 mL) ;水 g 。2 .量取:用量筒量取所需的氯化钠溶液和水,倒人烧杯中。3 .混匀:用玻璃棒搅拌,使溶液混合均匀。 把配制好的上述两种溶液分别装入 中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。252425试剂瓶① .使用天平时,应注意左 右 。② .因为水为液体,且其密度为 1g / cm3 , 所以测定水的体积比质量方便。③ .选择量筒的标准:量筒大小与所取液体体积最接近, 若大, 则残留在量筒壁上液体过多,且读数误差大, 若小,则量取次数多,误差大。④ .注意量筒的读数:视线与量筒里凹液面 处 保持 ,仰视读数偏 , 俯视读数偏 。注意事项:物砝最低水平低高小结 1 .配制一定量质量分数一定的溶液的基本步骤: ① ② ③ ④ 2 .仪器: 、 、 、 、 、 。 计算称量 / 量取溶解装瓶天平量筒烧杯玻璃棒药匙细口瓶讨论 哪些因素可造成配得的溶液溶质质量分 数偏低或偏高?偏低: 1 )称量固体时物体和砝码的位置放反, 导致称量固体质量偏小 偏高:量取水读数时,俯视液面, 导致量取水的体积偏小2 )量取水读数时,仰视液面,导致量取水的体积偏大小结:根据化学方程式计算中所用的物质的量都是指纯净物的质量,不纯物质(如溶液)必须换算成纯净物质的质量,再进...