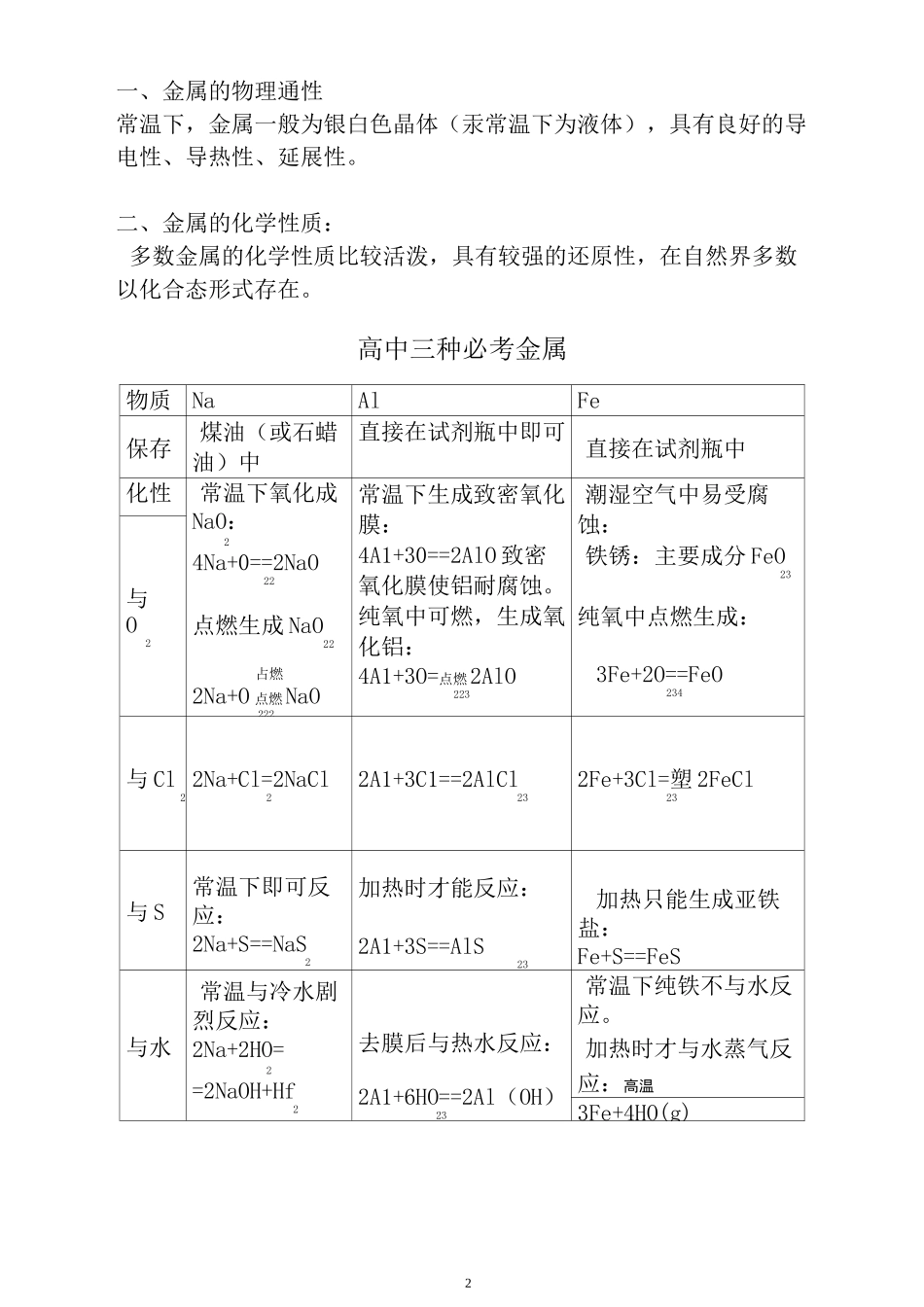
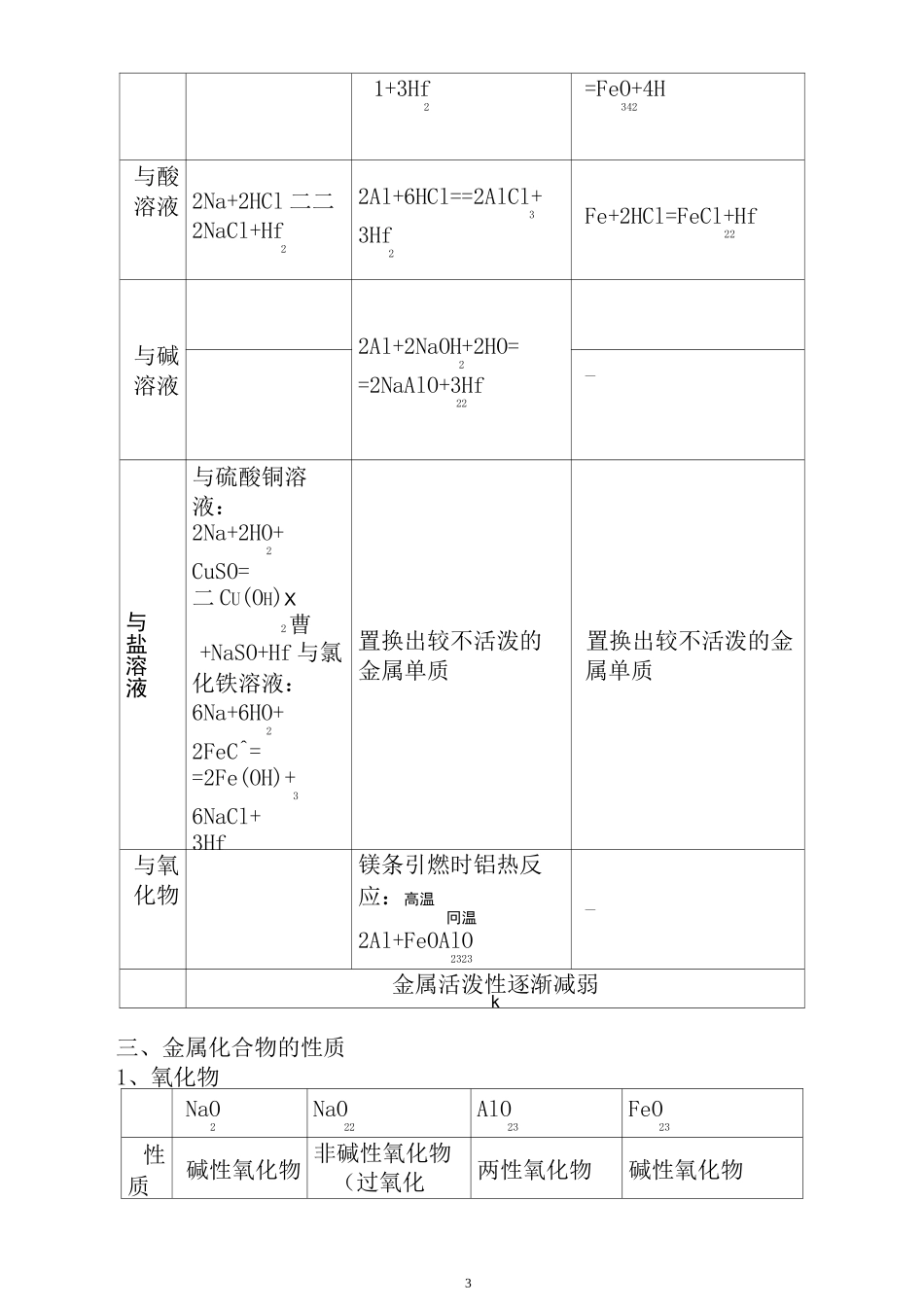
金属及其化合物讲义2一、金属的物理通性常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。二、金属的化学性质:多数金属的化学性质比较活泼,具有较强的还原性,在自然界多数以化合态形式存在。高中三种必考金属物质NaAlFe保存煤油(或石蜡油)中直接在试剂瓶中即可直接在试剂瓶中化性常温下氧化成NaO:24Na+0==2NaO22点燃生成 NaO22占燃2Na+O 点燃NaO222常温下生成致密氧化膜:4A1+30==2AlO 致密氧化膜使铝耐腐蚀。纯氧中可燃,生成氧化铝:4A1+3O=点燃2AlO223潮湿空气中易受腐蚀:铁锈:主要成分 FeO23纯氧中点燃生成:3Fe+2O==FeO234与O2与 Cl2 2Na+Cl=2NaCl22A1+3C1==2AlCl232Fe+3Cl=塑 2FeCl23与 S常温下即可反应:2Na+S==NaS2加热时才能反应:2A1+3S==AlS23加热只能生成亚铁盐:Fe+S==FeS与水常温与冷水剧烈反应:2Na+2HO=2=2NaOH+Hf2去膜后与热水反应:2A1+6HO==2Al(OH)23常温下纯铁不与水反应。加热时才与水蒸气反应:高温3Fe+4HO(g)31+3Hf2=FeO+4H342与酸溶液 2Na+2HCl 二二2NaCl+Hf22Al+6HCl==2AlCl+33Hf2Fe+2HCl=FeCl+Hf22与碱溶液2Al+2NaOH+2HO=2=2NaAlO+3Hf22—与盐溶液与硫酸铜溶液:2Na+2HO+2CuSO=二 CU(OH)X2曹+NaSO+Hf 与氯化铁溶液:6Na+6HO+22FeC^==2Fe(OH)+36NaCl+3Hf置换出较不活泼的金属单质置换出较不活泼的金属单质与氧化物镁条引燃时铝热反应:高温冋温2Al+FeOAlO2323+2Fe—金属活泼性逐渐减弱k三、金属化合物的性质1、氧化物NaO2NaO22AlO23FeO23性质碱性氧化物 非碱性氧化物(过氧化物)两性氧化物碱性氧化物4颜色状态白色固体淡黄色固体白色固体赤红色固体与水反应Na0+HO=22=2NaOH2NaO+2HO=222=4NaOH+Of2—与酸溶液NaO+2HCl=2=2NaCl+HO2(溶液无色)2NaO+4HCl=22=4NaCl+2HO2+Of2AlO+6HCl==232AlCl+3HO32FeO+6HCl=23=2FeCl+3HO(溶32液黄色)与碱溶液AlO+2NaOH=23=2NaAlO+HO22——其他NaO+CO=22=NaCO232NaO+2CO=222=2NaCO+O232—2、氢氧化物化性 NaOHAl(OH)3Fe(OH)2Fe(OH)3属性碱性氢氧化物两性氢氧化物碱性氢氧化物碱性氢氧化物与酸溶液NaOH+HCl 二二NaCl+HO2Al(OH)+3HC3l==AlCl+3HO32Fe(OH)+2HCl=2=FeCl+2HO22Fe(OH)+3HCl==3FeCl+3HO32与碱溶液Al(OH)+NaO3H==NaAlO+22HO2一—稳定性稳定△2Al(OH)==3AlO+3HO2324Fe(OH)+O+2HO=222=4Fe(OH)3△2Fe(OH)——3FeO+3HO2325其他2NaOH+CO=2NaCO+HO232NaOH+CO2(过量)二 NaHCO一—制备金属钠与水即可铝盐溶液与过量浓氨水亚铁盐...