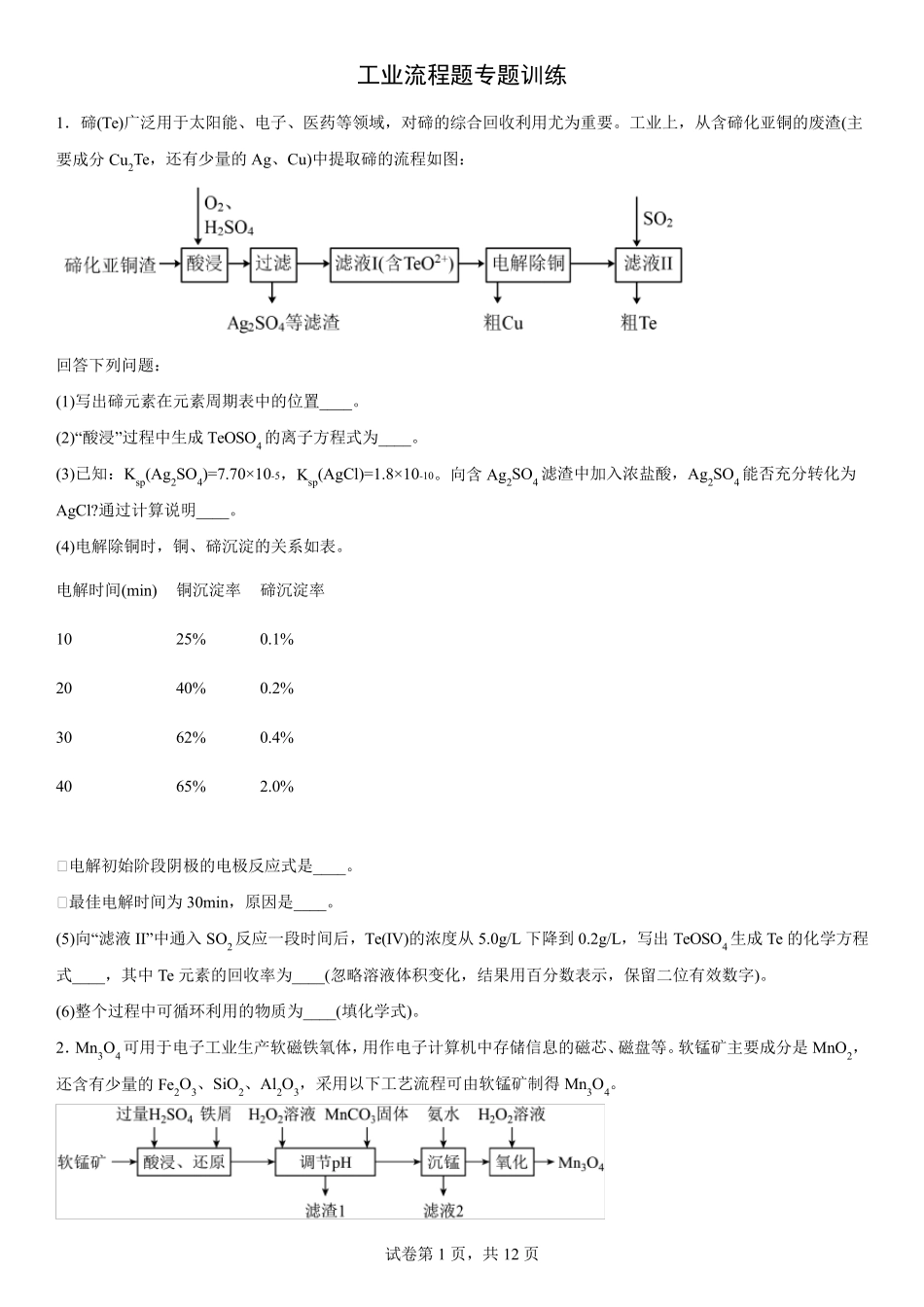
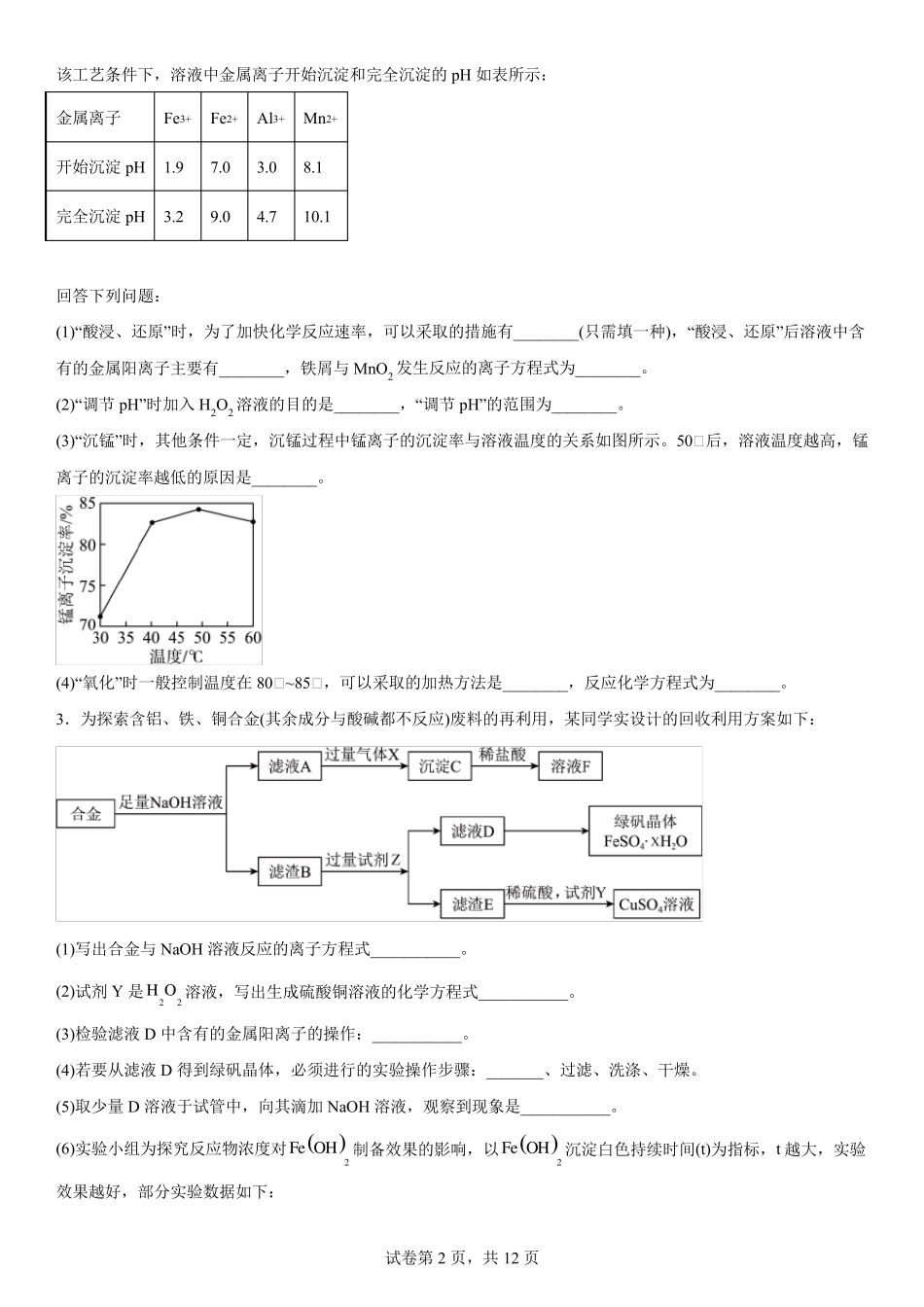
试卷第1 页,共12 页 工业流程题专题训练 1.碲(Te)广泛用于太阳能、电子、医药等领域,对碲的综合回收利用尤为重要。工业上,从含碲化亚铜的废渣(主要成分 Cu2Te,还有少量的 Ag、Cu)中提取碲的流程如图: 回答下列问题: (1)写出碲元素在元素周期表中的位置____。 (2)“酸浸”过程中生成 TeOSO4 的离子方程式为____。 (3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含 Ag2SO4 滤渣中加入浓盐酸,Ag2SO4 能否充分转化为AgCl?通过计算说明____。 (4)电解除铜时,铜、碲沉淀的关系如表。 电解时间(min) 铜沉淀率 碲沉淀率 10 25% 0.1% 20 40% 0.2% 30 62% 0.4% 40 65% 2.0% ① 电解初始阶段阴极的电极反应式是____。 ① 最佳电解时间为 30min,原因是____。 (5)向“滤液 II”中通入 SO2 反应一段时间后,Te(IV)的浓度从 5.0g/L 下降到 0.2g/L,写出 TeOSO4 生成 Te 的化学方程式____,其中 Te 元素的回收率为____(忽略溶液体积变化,结果用百分数表示,保留二位有效数字)。 (6)整个过程中可循环利用的物质为____(填化学式)。 2.Mn3O4 可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。软锰矿主要成分是 MnO2,还含有少量的 Fe2O3、SiO2、Al2O3,采用以下工艺流程可由软锰矿制得 Mn3O4。 试卷第2 页,共12 页 该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH 如表所示: 金属离子 Fe3+ Fe2+ Al3+ Mn2+ 开始沉淀pH 1.9 7.0 3.0 8.1 完全沉淀pH 3.2 9.0 4.7 10.1 回答下列问题: (1)“酸浸、还原”时,为了加快化学反应速率,可以采取的措施有________(只需填一种),“酸浸、还原”后溶液中含有的金属阳离子主要有________,铁屑与 MnO2 发生反应的离子方程式为________。 (2)“调节 pH”时加入 H2O2 溶液的目的是________,“调节 pH”的范围为________。 (3)“沉锰”时,其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。50① 后,溶液温度越高,锰离子的沉淀率越低的原因是________。 (4)“氧化”时一般控制温度在 80① ~85① ,可以采取的加热方法是________,反应化学方程式为________。 3.为探索含铝、铁、铜合金(其余成分与酸碱都不反应)废料的再利用,某同学实设计的回收利用方案如下: (1)写出合金与 NaOH 溶液反应的离子方程式___________。 (2)试剂 Y 是22H O 溶液,写...