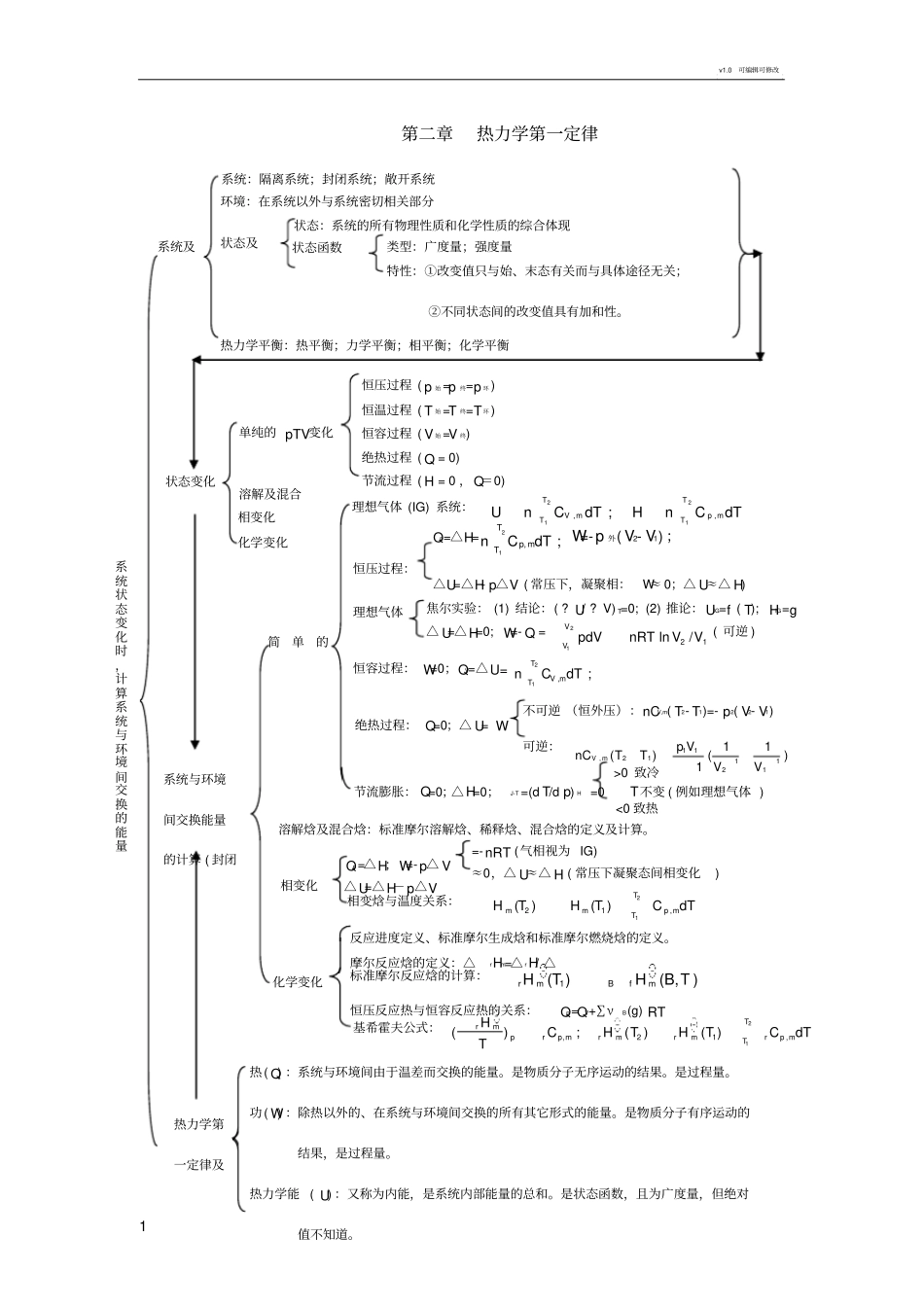
v1.0 可编辑可修改1 第二章热力学第一定律热 ( Q) :系统与环境间由于温差而交换的能量。是物质分子无序运动的结果。是过程量。功 ( W) :除热以外的、在系统与环境间交换的所有其它形式的能量。是物质分子有序运动的结果,是过程量。热力学能 ( U) :又称为内能,是系统内部能量的总和。是状态函数,且为广度量,但绝对值不知道。热力学第一定律及系统状态变化时,计算系统与环境间交换的能量状态变化溶解及混合化学变化相变化单纯的 pTV变化恒容过程 ( V 始 =V 终)恒温过程 ( T 始 =T 终=T 环 ) 恒压过程 ( p 始 =p 终=p 环 )绝热过程 ( Q = 0)节流过程 ( H = 0 ,Q=0)系统及环境:在系统以外与系统密切相关部分系统:隔离系统;封闭系统;敞开系统状态及状态:系统的所有物理性质和化学性质的综合体现类型:广度量;强度量特性:①改变值只与始、末态有关而与具体途径无关;②不同状态间的改变值具有加和性。状态函数热力学平衡:热平衡;力学平衡;相平衡;化学平衡溶解焓及混合焓:标准摩尔溶解焓、稀释焓、混合焓的定义及计算。系统与环境间交换能量的计算 ( 封闭简单的理想气体 (IG) 系统:2211,,;TTVmp mTTUnCdTHnCdT理想气体焦尔实验: (1) 结论:( ? U/ ? V) T=0; (2) 推论:UIG=f ( T); HIG=g △ U=△H=0; W=- Q =2121ln/VV pdVnRTVV ( 可逆 )恒容过程: W=0;QV=△U=21,;TV mTnCdT绝热过程: Q=0;△ U= W不可逆 (恒外压):nCV,m( T2- T1)=- p2( V2- V1)可逆:11,21112111()()1Vmp VnCTTVVQp=△H=21,;Tp mTnCdTW=-p 外( V2- V1) ;△U=△H- p△V ( 常压下,凝聚相:W≈ 0;△ U≈△ H)恒压过程:节流膨胀: Q=0;△H=0;J-T =(d T/d p) H =0 T不变 ( 例如理想气体 )<0 致热>0 致冷相变化△U=△H-p△VQp=△H; W=-p△ V≈0,△ U≈△ H ( 常压下凝聚态间相变化)=-nRT (气相视为 IG)相变焓与温度关系:2121,()()Tmmp mTHTHTCdT化学变化摩尔反应焓的定义:△rHm=△ rH/ △恒压反应热与恒容反应热的关系:Qp=QV+∑νB(g) RT标准摩尔反应焓的计算:1B()(B,)rmfmHTHT反应进度定义、标准摩尔生成焓和标准摩尔燃烧焓的定义。基希霍夫公式:21,21,();()()Trmprp mrmrmrp mTHCHTHTCdTTv1.0 可编辑可修改2 1. 当理想气体冲入一真空绝热容器后,其温度将 (a) 升高 (b) 降低(c) 不变 (d) 难以确定 ( 答案 )...