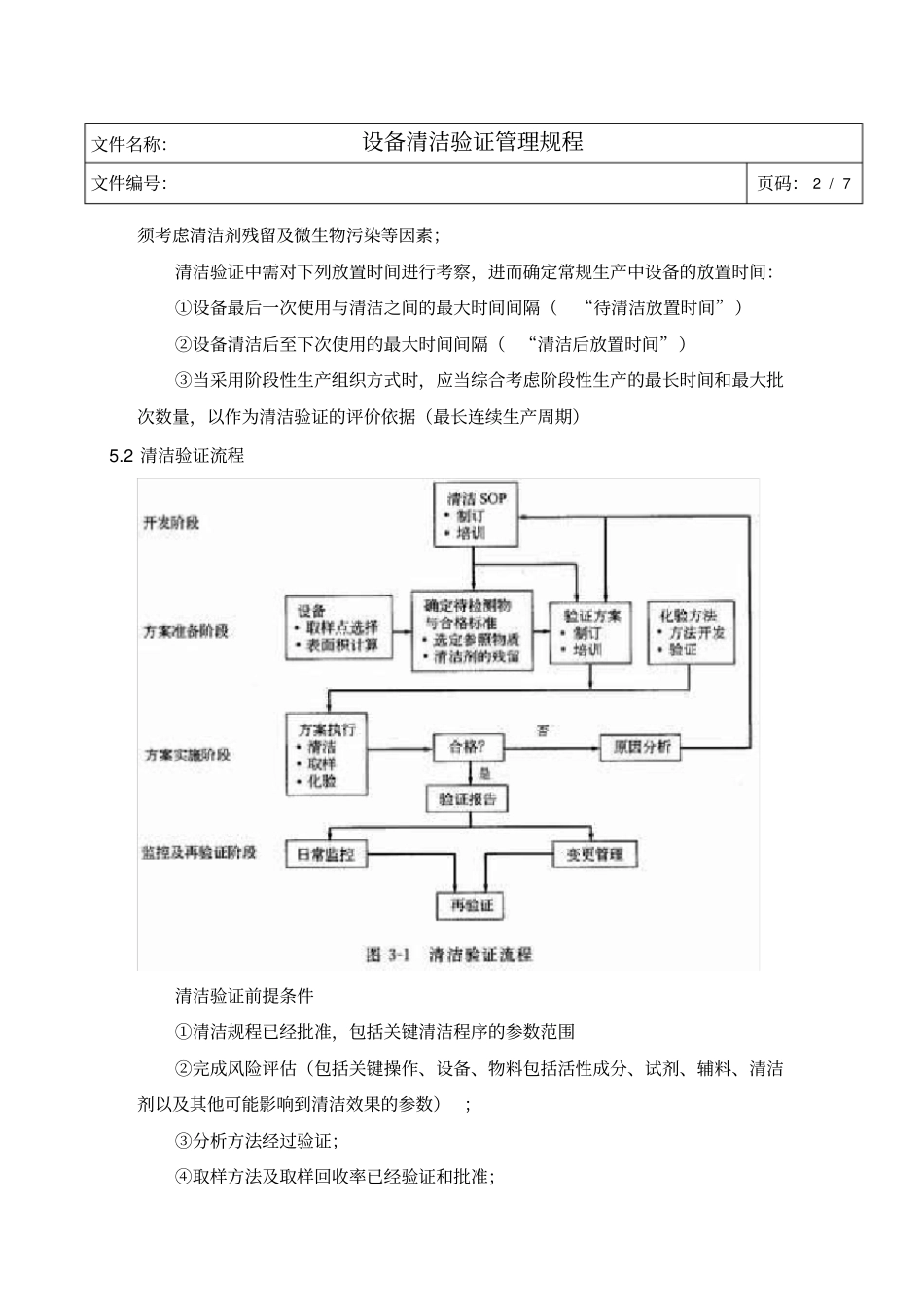
文件名称:设备清洁验证管理规程文件编号:页码: 1 / 7起草人:审核人:批准人:日 期:日 期:日 期:分发部门:行政部、质量保证部、质量控制部、生产管理部、设备工程部、口服固体制剂车间生效日期:1. 目的: 建立设备清洗验证管理规程,以规范设备清洗的验证工作。2. 范围: 本规程适用于安装试用前后设备、大修后设备、全部生产完成后设备清洁的验证。3. 职责: 公司质量负责人、验证小组成员及各部门负责人对本规程的实施负责。4. 依据:《药品生产质量管理规范》 (2010 年版)附录:确认与验证5. 程序5.1 清洁验证定义有文件和记录证明所批准的清洁规程能有效清洁设备,使之符合药品生产的要求。5.1.1清洁验证注意事项清洁验证应综合考虑设备使用情况、所使用的清洁剂和消毒剂、取样方法和位置以及相应的取样回收率、残留物的性质和限度、残留物检验方法的灵敏度等因素。5.1.2清洁验证的一般要求清洁验证是通过文件证明清洁程序有效性的活动,目的是确保产品不会受到来自于同一设备上生产的其他产品的残留物、清洁剂以及微生物污染;为了证明清洁程序的有效性,清洁验证的次数应当根据风险评估确定,通常应至少执行连续三个成功的清洁循环;清洁验证计划完成需要一定的时间,验证过程中每个批次后的清洁效果需及时进行确认;根据清洁验证结果,必要时,在清洁验证后应当对设备的清洁效果进行持续确认。对于专用设备,清洁验证可以不必对活性成分进行考察,但必须考虑清洁剂残留以及潜在的微生物污染等因素,对于一些特殊的产品,还应考察降解产物;对于没有与药物成分接触的设备,清洁验证可以不必对活性成分进行考察,但必文件名称:设备清洁验证管理规程文件编号:页码: 2 / 7须考虑清洁剂残留及微生物污染等因素;清洁验证中需对下列放置时间进行考察,进而确定常规生产中设备的放置时间:①设备最后一次使用与清洁之间的最大时间间隔(“待清洁放置时间”)②设备清洁后至下次使用的最大时间间隔(“清洁后放置时间”)③当采用阶段性生产组织方式时,应当综合考虑阶段性生产的最长时间和最大批次数量,以作为清洁验证的评价依据(最长连续生产周期)5.2 清洁验证流程清洁验证前提条件①清洁规程已经批准,包括关键清洁程序的参数范围②完成风险评估(包括关键操作、设备、物料包括活性成分、试剂、辅料、清洁剂以及其他可能影响到清洁效果的参数) ;③分析方法经过验证;④取样方法及取样回收率已经验证和...