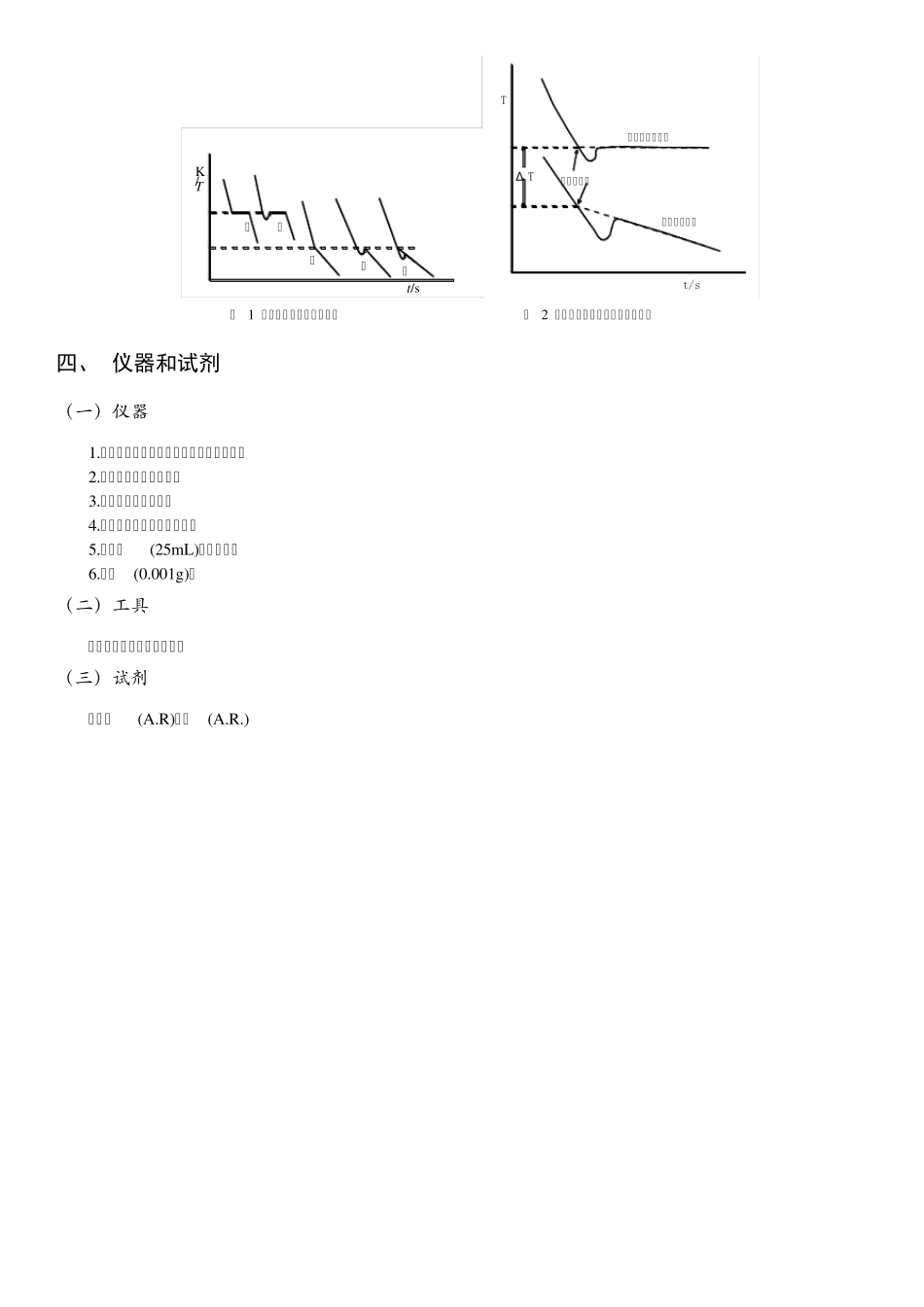
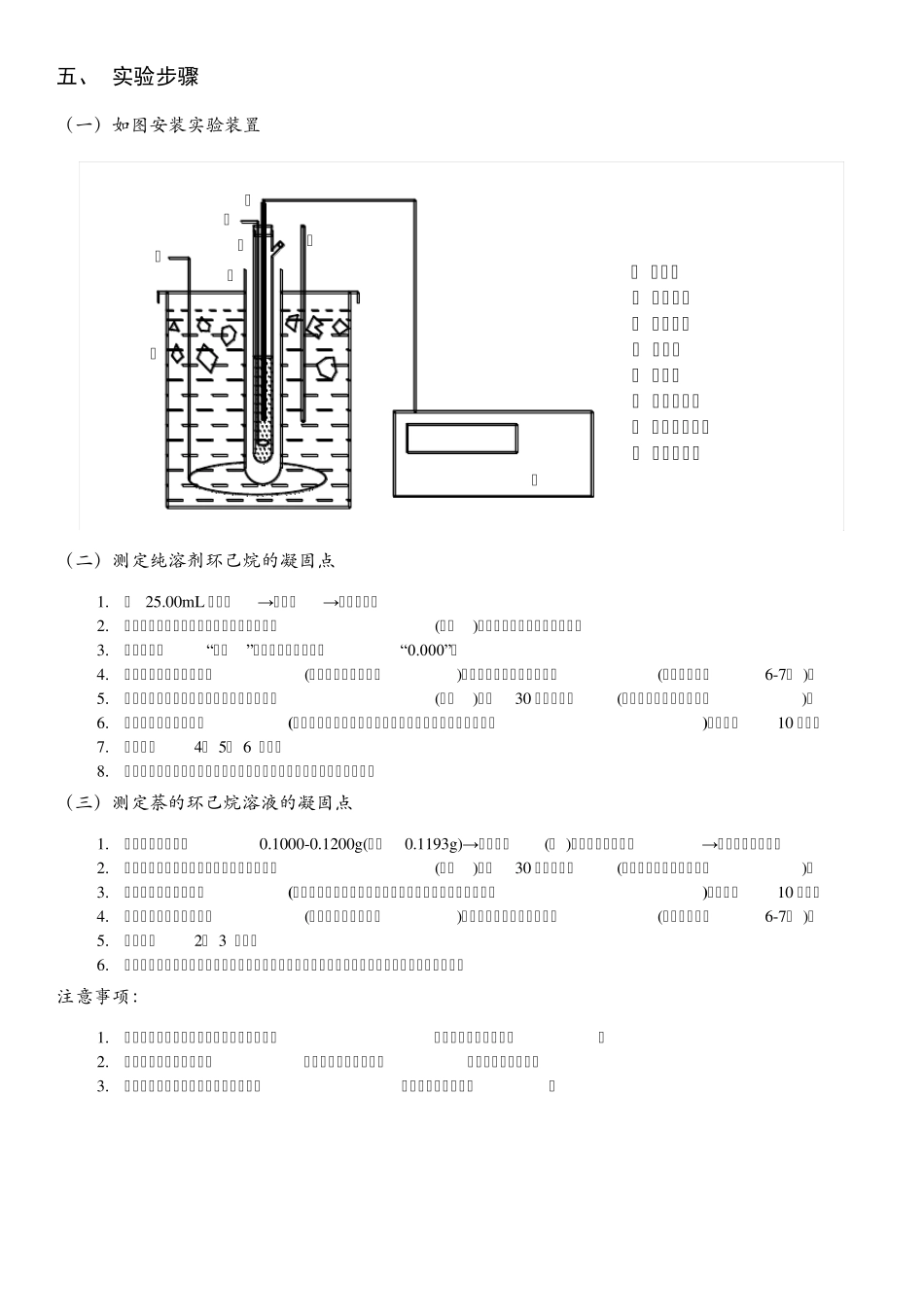
C 6 凝固点降低法测定摩尔质量 ——实验日期: 年 月 日 姓名: 学号: 班级: 一、 实验目的 (一)用凝固点降低法测定萘的摩尔质量。 (二)掌握精密电子温差仪的使用方法。 二、 原理及实验公式 非挥发性溶质二组分溶液,其稀溶液具有依数性,凝固点降低就是依数性的一种表现。根据凝固点降低的数值,可以求出溶质的摩尔质量。 在溶剂中加入溶质时,溶液的凝固点比纯溶剂的凝固点低,其凝固点降低值Δ 与溶质的质量摩尔浓度 成正比。 式中, 为纯溶剂的凝固点; 为浓度为 的溶液的凝固点; 为溶剂的凝固点降低常数。 若已知某种溶剂的凝固点降低常数 , 并测得溶剂和溶质的质量分别为 和 的稀溶液的凝固点降低值Δ ,则可以通过下式计算溶质的摩尔质量 。 式中, 的单位为 。 三、 凝固点的确定方法 (一)纯溶剂的凝固点确定方法 纯溶剂的凝固点为其液相和固相共存的平衡温度。若将液态的纯溶剂逐步冷却,在未凝固前温度将随时间均匀下降。开始凝固后因放出凝固热而补偿了热损失,体系将保持液-固两相共存的平衡温度而不变,直到全部凝固,温度再继续下降。冷却曲线如图1 中 1 所示。 但在实际过程中,液体温度达到或稍低于其凝固点时,晶体并不析出,此现象即过冷现象。此时若加以搅拌或加入晶种,促使晶核产生,则大量晶体迅速形成,并放出凝固热,使体系温度迅速回升到稳定的平衡温度,待液体全部凝固后,温度再逐渐下降。冷却曲线如图1 中 2 所示。 (二)溶液的凝固点确定方法 溶液的凝固点是该溶液与溶剂的固相共存的平衡温度,冷却曲线与纯溶剂不同。当有溶剂凝固析出时,剩余溶液的浓度逐渐增大,因而溶液的凝固点也逐渐下降。因有凝固热放出,冷却曲线的斜率发生变化,即温度的下降速度变慢,如图1 中 3 所示。本实验要求测定已知浓度溶液的凝固点。如果溶液过冷程度不大,析出固体溶剂的量很少,对原始溶液浓度影响不大,则以过冷回升的最高温度作为该溶液的凝固点,如图1 中 4 所示。 确定凝固点的另一种方法是外推法,如图2 所示,首先记录绘制纯溶剂与溶液的冷却曲线,作曲线后面部分(已经有固体析出)的趋势线并延长使其与曲线的前面部分相交,其交点即为凝固点。 图 1 纯溶剂和溶液的冷却曲线 图 2 外推法求纯溶剂和溶液的凝固点 四、 仪器和试剂 (一)仪器 1.凝固点管、凝固点管塞、凝固点管套管; 2.小搅拌杆、大搅拌杆; 3.水浴缸、水浴缸盖; 4.精密...