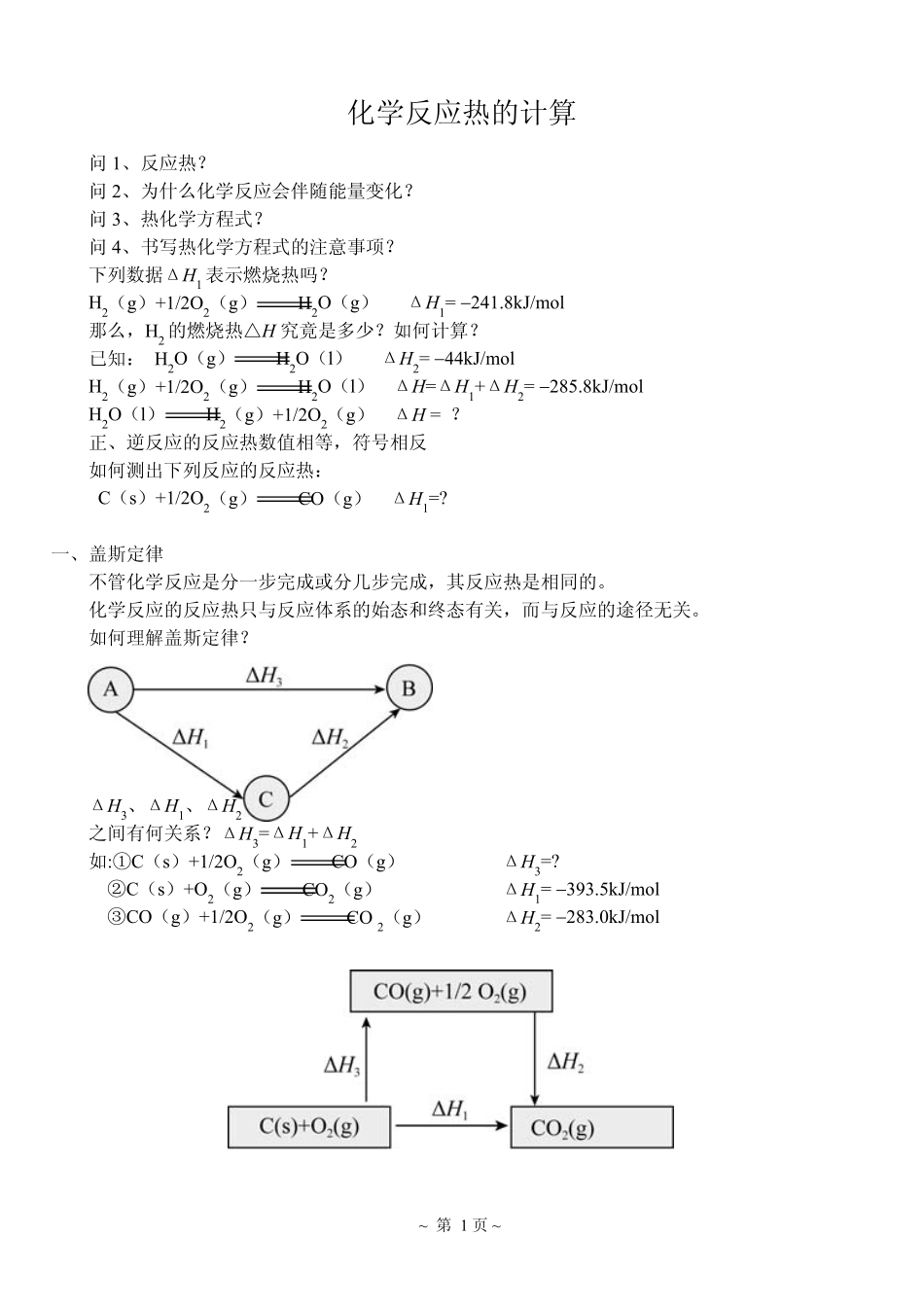
~ 第 1 页 ~ 化学反应热的计算 问1、反应热? 问2、为什么化学反应会伴随能量变化? 问3、热化学方程式? 问4、书写热化学方程式的注意事项? 下列数据ΔH1 表示燃烧热吗? H2(g)+1/2O2(g)H2O(g) ΔH1= −241.8kJ/mol 那么,H2 的燃烧热△H 究竟是多少?如何计算? 已知: H2O(g)H2O(l) ΔH2= −44kJ/mol H2(g)+1/2O2(g)H2O(l) ΔH=ΔH1+ΔH2= −285.8kJ/mol H2O(l)H2(g)+1/2O2(g) ΔH = ? 正、逆反应的反应热数值相等,符号相反 如何测出下列反应的反应热: C(s)+1/2O2(g)CO(g) ΔH1=? 一、盖斯定律 不管化学反应是分一步完成或分几步完成,其反应热是相同的。 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。 如何理解盖斯定律? ΔH3、ΔH1、ΔH2 之间有何关系?ΔH3=ΔH1+ΔH2 如:①C(s)+1/2O2(g)CO(g) ΔH3=? ②C(s)+O2(g)CO2(g) ΔH1= −393.5kJ/mol ③CO(g)+1/2O2(g) CO 2(g) ΔH2= −283.0kJ/mol ~ 第 2 页 ~ ΔH1 =ΔH3 +ΔH2 ΔH3 =ΔH1 −ΔH2 = −393.5kJ/mol + 283.0kJ/mol = −110.5kJ/mol 例 1:写出石墨变成金刚石的热化学方程式(25℃,101 kPa 时) 说明: 查燃烧热表知: ①C(石墨,s)+O2(g)CO2(g) ΔH1= −393.5kJ/mol ②C(金刚石,s)+O2(g)CO2(g) ΔH2= −395.0kJ/mol 所以, ①−②得: C(石墨,s)= C(金刚石,s) ΔH= +1.5kJ/mol 例 2:某次发射火箭,用 N2H4(肼)在 NO2 中燃烧,生成 N2、液态 H2O。已知: N2(g)+2O2(g)2NO2(g) ΔH1= +67.2kJ/mol N2H4(g)+O2(g)N2(g)+2H2O(l) ΔH2= −534kJ/mol 假如都在相同状态下,请写出发射火箭反应的热化学方程式。 2N2H4(g)+ 2NO2(g) 3N 2(g)+4H2O(l) ΔH= −1135.2kJ/mol 盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同.换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关. 因为有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难 .此时如果应用盖斯定律,就可以间接地把它们的反应热计算出来. 二、有关反应热的计算 注意事项: 1、ΔH 值的“+”、“−”号应并同计算过程; 2、 ΔH 的单位(kJ/mol)中的“/mol”不是指每摩尔物质,而是指“每摩尔反应...