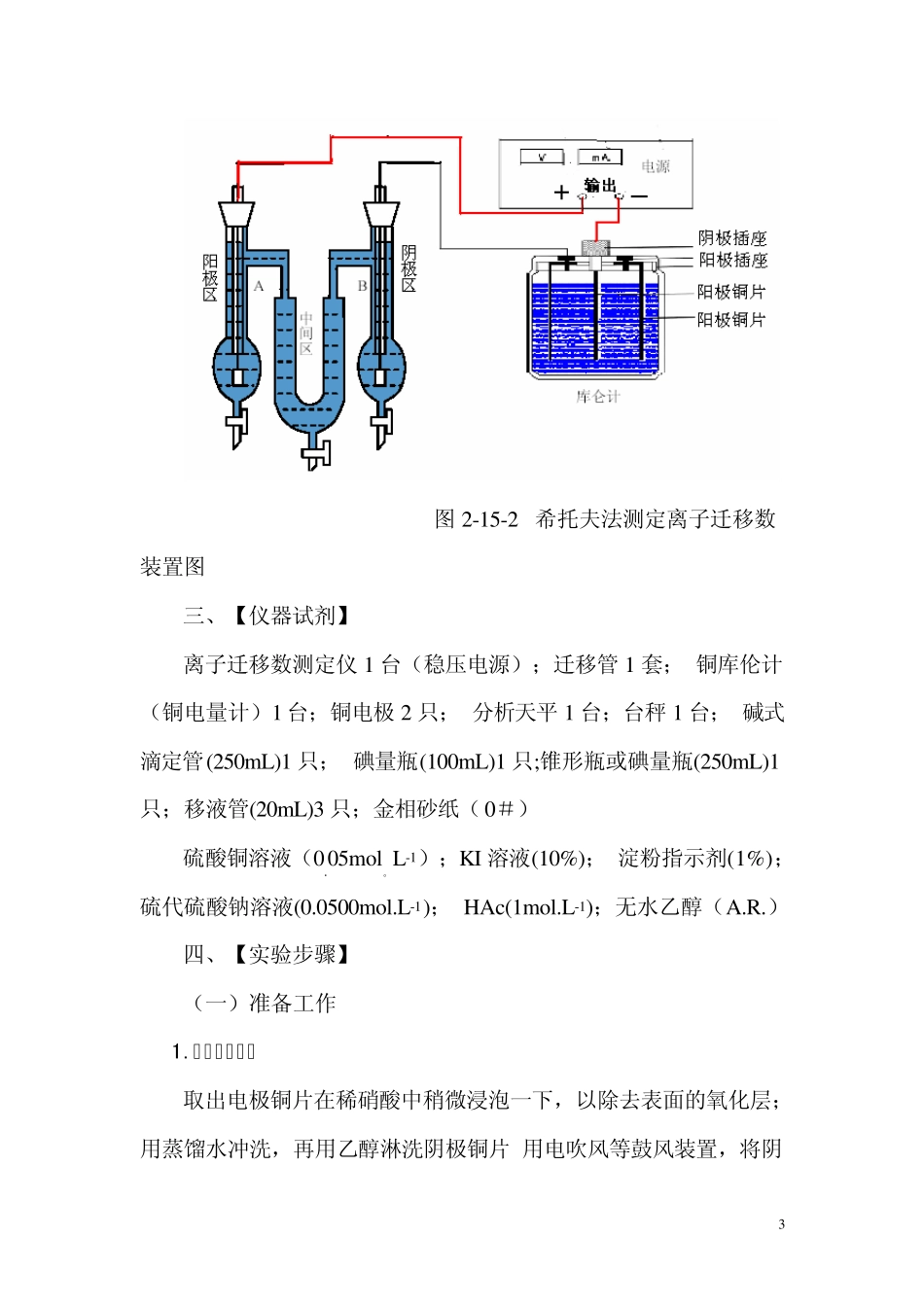
1 实验十 离子迁移数的测定 一、【目的要求】 1.掌握希托夫法测定电解质溶液中离子迁移数的某本原理和操作方法。 2.测定 CuSO4溶液中 Cu2+和 SO42-的迁移数。 二、【实验原理】 当电流通过电解质溶液时,溶液中的正负离子各自向阴、阳两极迁移,由于各种离子的迁移速度不同,各自所带过去的电量也必然不同。每种离子所带过去的电量与通过溶液的总电量之比,称为该离子在此溶液中的迁移数。若正负离子传递电量分别为 q+和 q-,通过溶液的总电量为 Q, 则正负离子的迁移数分别为: t+=q+/Q t-=q-/Q 离子迁移数与浓度、温度、溶剂的性质有关,增加某种离子的浓度则该离子传递电量的百分数增加,离子迁移数也相应增加;温度改变,离子迁移数也会发生变化,但温度升高正负离子的迁移数差别较小;同一种离子在不同电解质中迁移数是不同的。 离子迁移数可以直接测定,方法有希托夫法、界面移动法和电动势法等。 用希托夫法测定 CuSO4 溶液中 Cu2+和 SO42-的迁移数时,在溶液中间区浓度不变的条件下,分析通电前原溶液及通电后阳极区(或阴极区)溶液的浓度,比较等重量溶剂所含 MA 的量,可计算出通电后 2 迁移出阳极区(或阴极区)的MA 的量。通过溶液的总电量Q 由串联在电路中的电量计测定。可算出t+和t-。 在迁移管中,两电极均为Cu 电极。其中放Cu SO4 溶液。通电时,溶液中的Cu 2+在阴极上发生还原,而在阳极上金属铜溶解生成Cu 2+。 阳极反应:Cu – 2e → Cu 2+ 阴极反应:Cu 2+ + 2e → Cu 因此,通电时一方面阳极区有 Cu 2+迁移出,另一方面电极上Cu溶解生成Cu 2+,因而有 nnnn迁后原 电 2uCntn 迁电,2241uSOCtt 式中n迁表示迁移出阳极区的电荷的量,n原表示通电前阳极区所含电荷的量,n后表示通电后阳极区所含 Cu 2+的量。n电用表示通电时阳极上Cu 溶解(转变为Cu 2+)的量也等于铜电量计阴极上析出铜的量的2 倍,可以看出希托夫法测定离子的迁移数至少包括两个假定: (1)电的输送者只是电解质的离子,溶剂水不导电,这一点与实际情况接近。 (2)不考虑离子水化现象。 实际上正、负离子所带水量不一定相同,因此电极区电解质浓度的改变,部分是由于水迁移所引起的,这种不考虑离子水化现象所测得的迁移数称为希托夫迁移数。 通过溶液的总电荷量阳极区增加的电解质t 3 图2-15-2 希托夫法测定离子迁移数装置图 三、【仪器试剂】 离子迁移数...