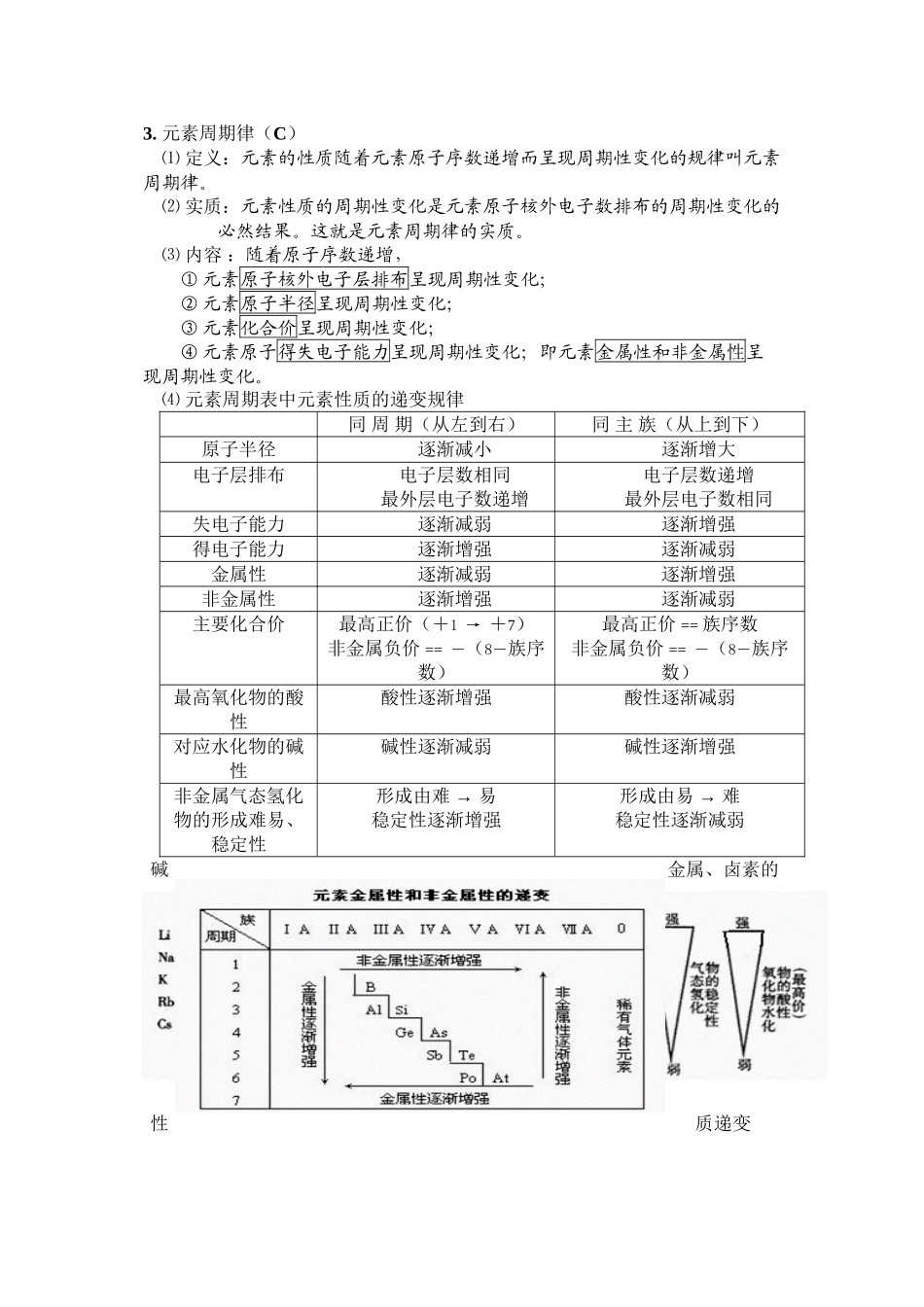
3. 元素周期律(C) ⑴ 定义:元素的性质随着元素原子序数递增而呈现周期性变化的规律叫元素周期律。 ⑵ 实质:元素性质的周期性变化是元素原子核外电子数排布的周期性变化的必然结果。这就是元素周期律的实质。 ⑶ 内容 :随着原子序数递增,① 元素原子核外电子层排布呈现周期性变化; ② 元素原子半径呈现周期性变化; ③ 元素化合价呈现周期性变化; ④ 元素原子得失电子能力呈现周期性变化;即元素金属性和非金属性呈现周期性变化。 ⑷ 元素周期表中元素性质的递变规律 同 周 期(从左到右) 同 主 族(从上到下)原子半径逐渐减小逐渐增大电子层排布电子层数相同最外层电子数递增电子层数递增最外层电子数相同失电子能力逐渐减弱逐渐增强得电子能力逐渐增强逐渐减弱金属性逐渐减弱逐渐增强非金属性逐渐增强逐渐减弱主要化合价最高正价(+1 → +7) 非金属负价 == ―(8―族序数) 最高正价 == 族序数 非金属负价 == ―(8―族序数)最高氧化物的酸性酸性逐渐增强酸性逐渐减弱对应水化物的碱性碱性逐渐减弱碱性逐渐增强非金属气态氢化物的形成难易、稳定性 形成由难 → 易稳定性逐渐增强形成由 → 易难稳定性逐渐减弱碱金属、卤素的性质递变 ⑸ 几个规律① 金属性强弱: 单质与水或非氧化性酸反应难易;单质的还原性(或离子的氧化性);M(OH)n的碱性;金属单质间的置换反应;原电池中正负极判断,金属腐蚀难易; 非金属性强弱: 与氢气反应生成气态氢化物难易;单质的氧化性(或离子的还原性);最高价氧化物的水化物(HnROm)的酸性强弱;非金属单质间的置换反应。 ② 半径比较三规律:阴离子与同周期稀有气体电子层结构相同;阳离子与上周期稀有气体电子层结构相同。 a.非金属元素的原子半径 < 其相应的阴离子半径;b.金属元素的原子半径 > 其相应的阳离子半径;c.具有相同电子层结构的阴阳离子,随着元素原子序数的递增,离子半径逐渐减 ③ 元素化合价规律a.最高正价 == 最外层电子数,非金属的负化合价 == 最外层电子数-8,b.最高正价数和负化合价绝对值之和为 8;c.化合物氟元素、氧元素只有负价(-1、-2),但 HFO 中 O 为 0;金属元素只有正价;d.化合价与最外层电子数的奇、偶关系:最外层电子数为奇数的元素,其化合价通常为奇数,如 Cl 的化合价有+1、+3、+5、+7 和-1 价。最外层电子数为偶数的元素,其化合价通常为偶数,如 S 的化合价有-2、+4、+6...