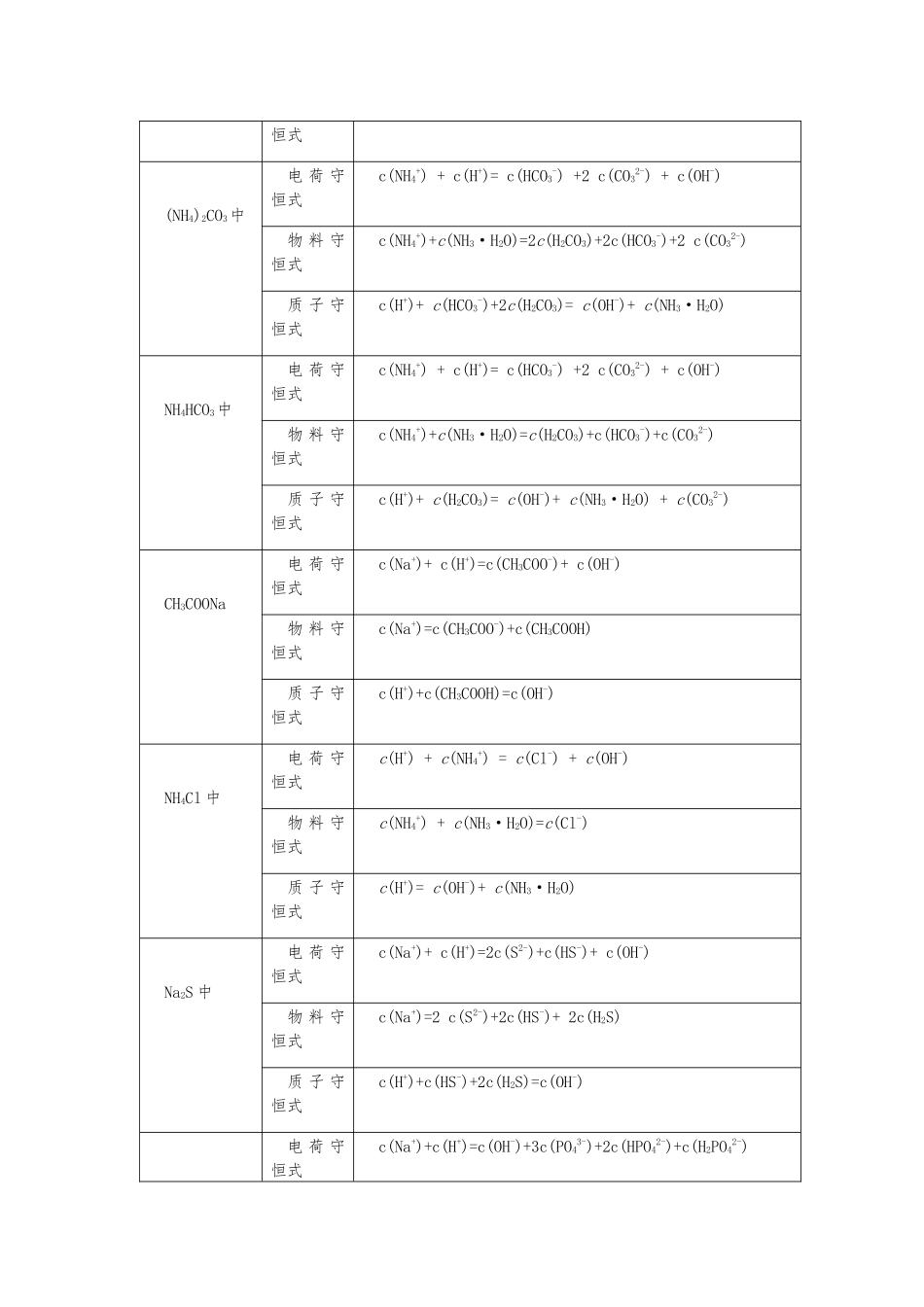
溶液中的三大守恒关系适用学科高中化学适用年级高中三年级适用区域课标版试用地区课时时长(分钟)60知识点1.溶液中三个守恒关系的书写2.三个守恒关系的应用3.比较离子浓度大小的方法与规律4.影响水解平衡的因素教学目标知识与技能:掌握溶液中的三个守恒关系过程与方法:培育学生的观察能力、分析能力和解决实际问题的能力情感态度与价值观:体验科学探究的艰辛与愉悦,增强为人类的文明进步学习化学的责任感和使命感。教学重点溶液中三个守恒关系的书写、三个守恒关系的应用教学难点溶液中三个守恒关系的书写、三个守恒关系的应用教学过程 一、复习预习复习盐类水解的相关知识,了解盐类水解的实质 二、知识讲解考点 1:电荷守恒电解质溶液中的阴离子的负电荷总数等于阳离子的正电荷总数例如,在 NaHCO3溶液中,有如下关系:C(Na+)+c(H+)==c(HCO3―)+c(OH―)+2c(CO32―)考点 2:物料守恒就电解质溶液而言,物料守恒是指电解质发生变化(反应或电离)前某元素的原子(或离子)的物质的量等于电解质变化后溶液中所有含该元素的原子(或离子)的物质的量之和实质上,物料守恒属于原子个数守恒和质量守恒。例如:在 Na2S 溶液中存在着 S2―的水解、HS―的电离和水解、水的电离,粒子间有如下关系c(S2―)+c(HS―)+c(H2S)==1/2c(Na+) ( Na+,S2―守恒)C(HS―)+2c(S2―)+c(H)==c(OH―) (H、O 原子守恒)例如:在 NaHS 溶液中存在着 HS―的水解和电离与水的电离。HS―+H2OH2S+OH―;HS―H++S2―;H2OH++OH―从物料守恒的角度分析,有如下等式:c(HS―)+C(S2―)+c(H2S)==c(Na+);从电荷守恒的角度分析,有如下等式:c(HS―)+2(S2―)+c(OH―)==c(Na+)+c(H+);将以上两式相加,有:c(S2―)+c(OH―)==c(H2S)+c(H+)得出的式子被称为质子守恒考点 3:质子守恒无论溶液中结合氢离子还是失去氢离子,但氢原子总数始终为定值,也就是说结合的氢离子的量和失去氢离子的量相等。 电荷守恒式与物料守恒式相加减可得质子守恒式考点 4:几种常见物质的三大守恒Na2CO3中电 荷 守恒式c(Na+) + c(H+)= c(HCO3-) +2 c(CO32-) + c(OH-)物 料 守恒式c(Na+) =2 c(CO32-) +2c(HCO3-) +2c(H2CO3)质 子 守恒式c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3)NaHCO3中电 荷 守恒式c(Na+) + c(H+)= c(HCO3-) +2 c(CO32-) + c(OH-)物 料 守恒式c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)质 子 守c(H2CO3) +c(H+)= c(CO32-)+ c(OH-) ...