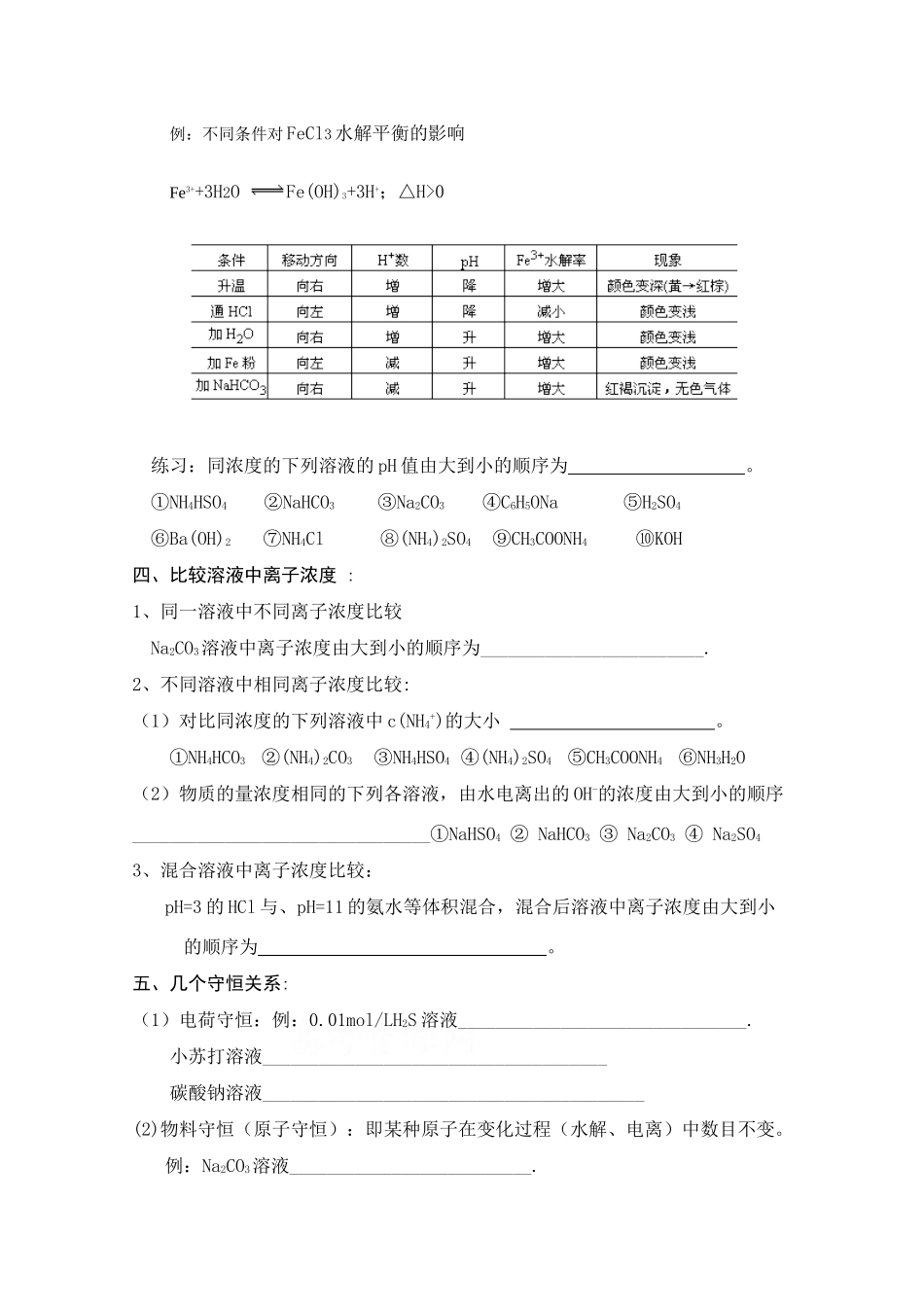
高三化学复习备考学案盐类的水解高考要求:理解盐类水解的原理。了解盐溶液的酸碱性。 一、盐类的水解1、实质:盐中 与水电离出的 结合生成 ,破坏 ,_______水的电离,造成了溶液中______和________不相等,使溶液显示不同程度的酸碱性.2、特征:① 属可逆反应,其逆反应为 。② 水解反应为 热反应。③ 水解程度一般微弱。3、水解离子方程式的书写的注意事项:① 盐类水解的程度通常是很小的,所以书写方程式时用“ _ ”。② 水解反应生成的挥发性物质和难溶性物质一般不标 “ _ ” 和 “ _ ”。如 Cu2+的水解 :_____________________③ 多元弱酸根水解是 进行的,多元弱碱阳离子一步写到位。如 S2-的水解 :_____________________, _____________________。Al3+的水解:_____________________ 二、水解规律:1、谁弱水水解,谁强显谁性(1)强碱弱酸盐:发生水解的离子为 ,溶液显 性。如 CH3COONa 水解离子方程式为: ;Na2CO3水解离子方程式: 。(2)强酸弱碱盐:发生水解的离子为 ,溶液显 性。如 FeCl3水解离子方程式为: 。 NH4Cl 水解化学方程式为: 。(3)弱酸弱碱盐:都弱都水解。水解程度增大,溶液可能显 性,这取决于水解生成的弱酸、弱碱相对电离程度的大小,一般不做要求。(4) 强酸强碱正盐:不水解,溶液显 性。如 NaCl、Na2SO4等。2、水解程度的判断:越弱越水解(1)比较均为 0.1mol/L 的 NaCl、NaF、CH3COONa、Na2CO3、NaHCO3的 pH_______________________________________________________________(2)已知电离程度:H2CO3〉C6H5OH〉HCO3-,则同浓度的碳酸钠、苯酚钠、碳酸氢钠的碱性强弱顺序是:_______________________________3、强烈双水解:指能使水解反应进行到底,生成沉淀、气体的弱酸弱碱这时要用=连接,沉淀标↓符号,气体标↑符号。① 如 Al3+与 S2-、HS-、CO32-、HCO3-、AlO2- SO32-、HSO3-在溶液中水解进行到底,②Fe3+与 CO32-、HCO3-、AlO2-在溶液中水解进行到底,但 Fe3+与 S2-、HS- SO32-、HSO3-为氧化还原反应。练习:写出下列反应的化学方程式、离子方程式:Al2(SO4)3溶液和 Na2CO3溶液:Al2(SO4)3溶液和 NaHCO3溶液:Al2(SO4)3溶液和 NaAlO2溶液:4、酸式盐溶液的酸碱性的判断:酸式盐溶液的酸碱性通常由水解和电离程度的相对大小来决定。例如:(1)NaHSO3 NaH2PO4 溶液显 ________性,因为_________________________(2)NaHS N...