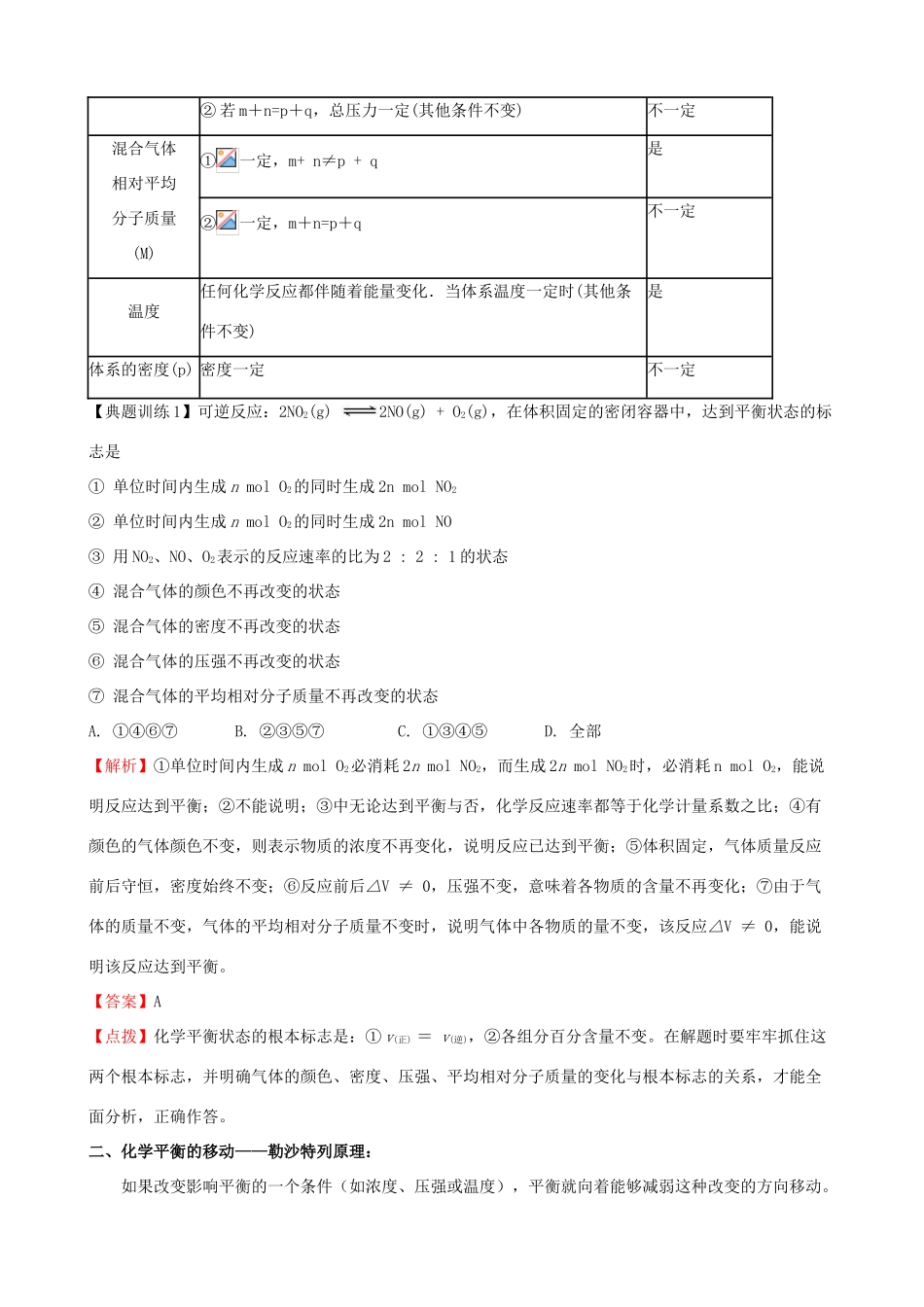
2011 届高考化学二轮专题复习学案:2.2 化学反应速率和化学平衡(新课标)【考纲点击】1. 了解化学反应速率的概念,反应速率的定量表示方法。2. 了解催化剂在生产、生活和科学研究领域中的重大作用。3. 理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,认识其一般规律。4. 了解化学反应速率的调控在生活、生产和科学研究领域中的作用。5. 了解化学反应的可逆性。6. 了解化学平衡建立的过程。理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。7. 理解外界条件(温度、压强、催化剂)对化学反应平衡的影响,认识其一般规律。了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。【核心要点突破】一、可逆反应达到平衡状态的判据点拨:例举反应mA(g)+nB(g) pC(g)’qD(g)是否平衡状态混合物体系中各成① 各物质的物质的量或各物质的物质的量的分数一定② 各物质的质量或各物质质量分数一定③ 各气体的体积或体积分数一定是④ 总体积、总压力、总物质的量一定不一定正反应速率与逆反应速率的关系① 在单位时间内消耗了 m mol A 同时生成,m molA,即 V 正=V 逆是② 在单位时间内消耗了 n molB 同时消耗了 p mol C。则 V 正=V逆是③VA:VB:VC:VD=m:n:p:q,V 正不一定等于 V 逆不一定④ 在单位时问内生成 n mol B。同时消耗 q mol D,因均指 V 逆 不一定压强①m+ n≠p + q 时。总压力一定(其他条件不变)是② 若 m+n=p+q,总压力一定(其他条件不变)不一定混合气体相对平均分子质量(M)①一定,m+ n≠p + q是②一定,m+n=p+q不一定温度任何化学反应都伴随着能量变化.当体系温度一定时(其他条件不变)是体系的密度(p) 密度一定不一定【典题训练 1】可逆反应:2NO2(g) 2NO(g) + O2(g),在体积固定的密闭容器中,达到平衡状态的标志是① 单位时间内生成 n mol O2的同时生成 2n mol NO2② 单位时间内生成 n mol O2的同时生成 2n mol NO③ 用 NO2、NO、O2表示的反应速率的比为 2 : 2 : 1 的状态 ④ 混合气体的颜色不再改变的状态⑤ 混合气体的密度不再改变的状态⑥ 混合气体的压强不再改变的状态⑦ 混合气体的平均相对分子质量不再改变的状态A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部【解析】①单位时间内生成 n mol O2必消耗 2n mol NO2,而生成 2n mol NO2时,必消耗 n mol O2,能说明反应达到平衡;...