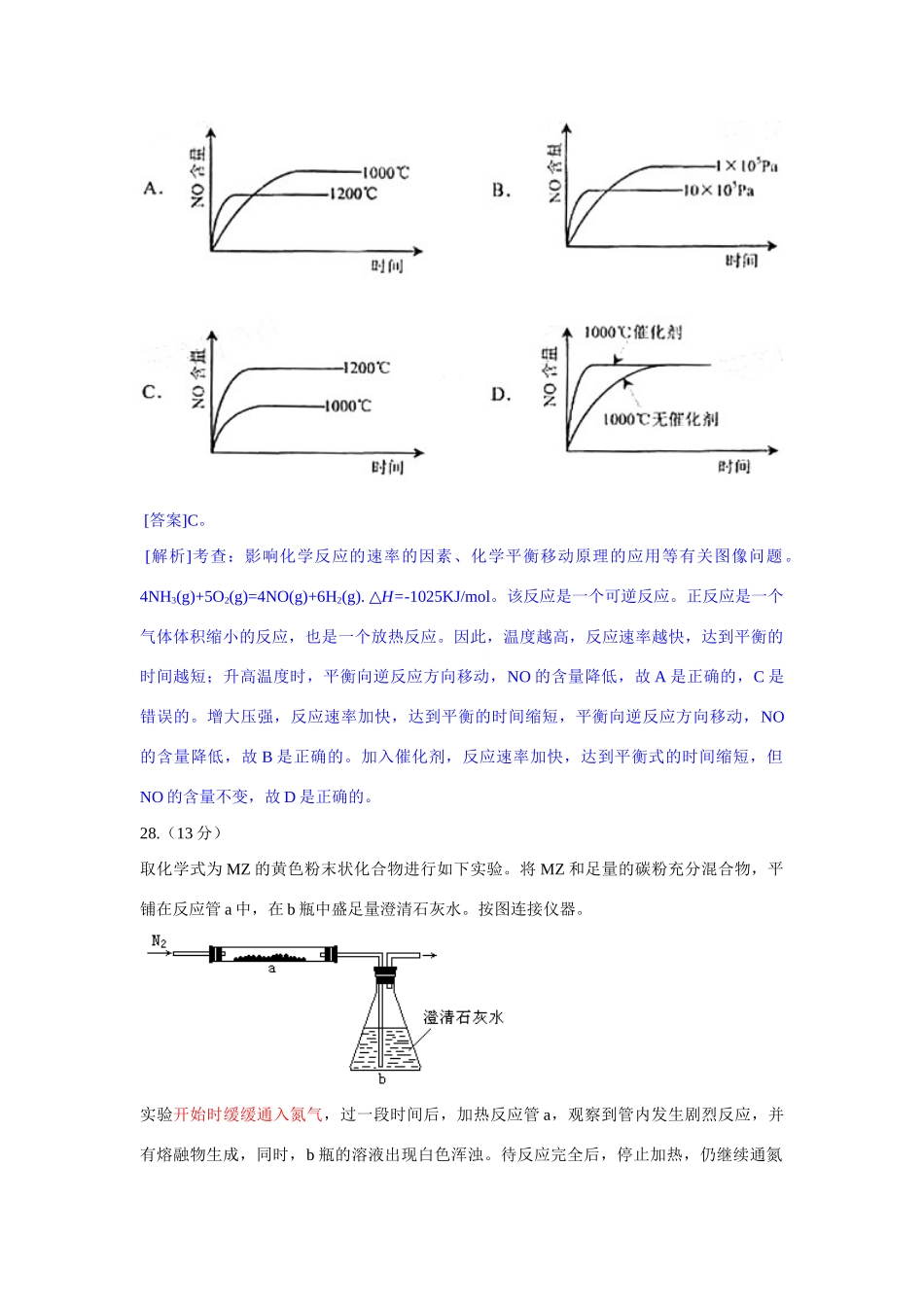
高考分类整理---------氮族元素全国 16.在溶液中加入足量的 Na2O2后仍能大量共存的离子组是A.NH4+、Ba2+、Cl—、NO3— B.K+、AlO2—、Cl—、SO42—C.Ca2+、Mg2+、NO3—、HCO3— D.Na+、Cl—、CO32—、SO32—[答案] B。[解析]考查:给定条件下的离子共存问题,过氧化钠的性质、。过氧化钠有强氧化性,溶于水生成氢氧化钠和氧气。A 中,NH4++OH-=NH3·H2O;B 中的离子之间不发生反应,与过氧化钠也不反应,故可以大量共存。C 中,HCO3—+OH—=CO32—+H2O,Ca2++ CO3— =CaCO3↓,Mg2++CO32—=MgCO3↓;D 中的 SO32—具有较强的还原性,过氧化钠会将其氧化成 SO42-。9.下列各组给定原子序数的元素,不能形成原子数之比为 1:1 稳定化合物的是A.3 和 17 B.1 和 8 C.1 和 6 D.7 和 12[答案]D。[解析]考查:原子序数、原子结构与物质构成的关系。可将具体元素代入后再判断。各选项对应的元素和构成符合要求的化合物依次是:A.锂和氯,LiCl;B 项中,H 和 O,H2O2;C 项中,H 和 C,C6H6、C2H2 等;D 项中,N 和Mg,Mg3N2。11.已知:4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g),△H = —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是 [答案]C。 [解析]考查:影响化学反应的速率的因素、化学平衡移动原理的应用等有关图像问题。4NH3(g)+5O2(g)=4NO(g)+6H2(g). H=-△1025KJ/mol。该反应是一个可逆反应。正反应是一个气体体积缩小的反应,也是一个放热反应。因此,温度越高,反应速率越快,达到平衡的时间越短;升高温度时,平衡向逆反应方向移动,NO 的含量降低,故 A 是正确的,C 是错误的。增大压强,反应速率加快,达到平衡的时间缩短,平衡向逆反应方向移动,NO的含量降低,故 B 是正确的。加入催化剂,反应速率加快,达到平衡式的时间缩短,但NO 的含量不变,故 D 是正确的。28.(13 分)取化学式为 MZ 的黄色粉末状化合物进行如下实验。将 MZ 和足量的碳粉充分混合物,平铺在反应管 a 中,在 b 瓶中盛足量澄清石灰水。按图连接仪器。实验开始时缓缓通入氮气,过一段时间后,加热反应管 a,观察到管内发生剧烈反应,并有熔融物生成,同时,b 瓶的溶液出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却,此时,管中的熔融物凝固城银白色金属。根据以上叙述回答:(1)元素 Z 是 ;(2)停止加热前是否需要先断开...