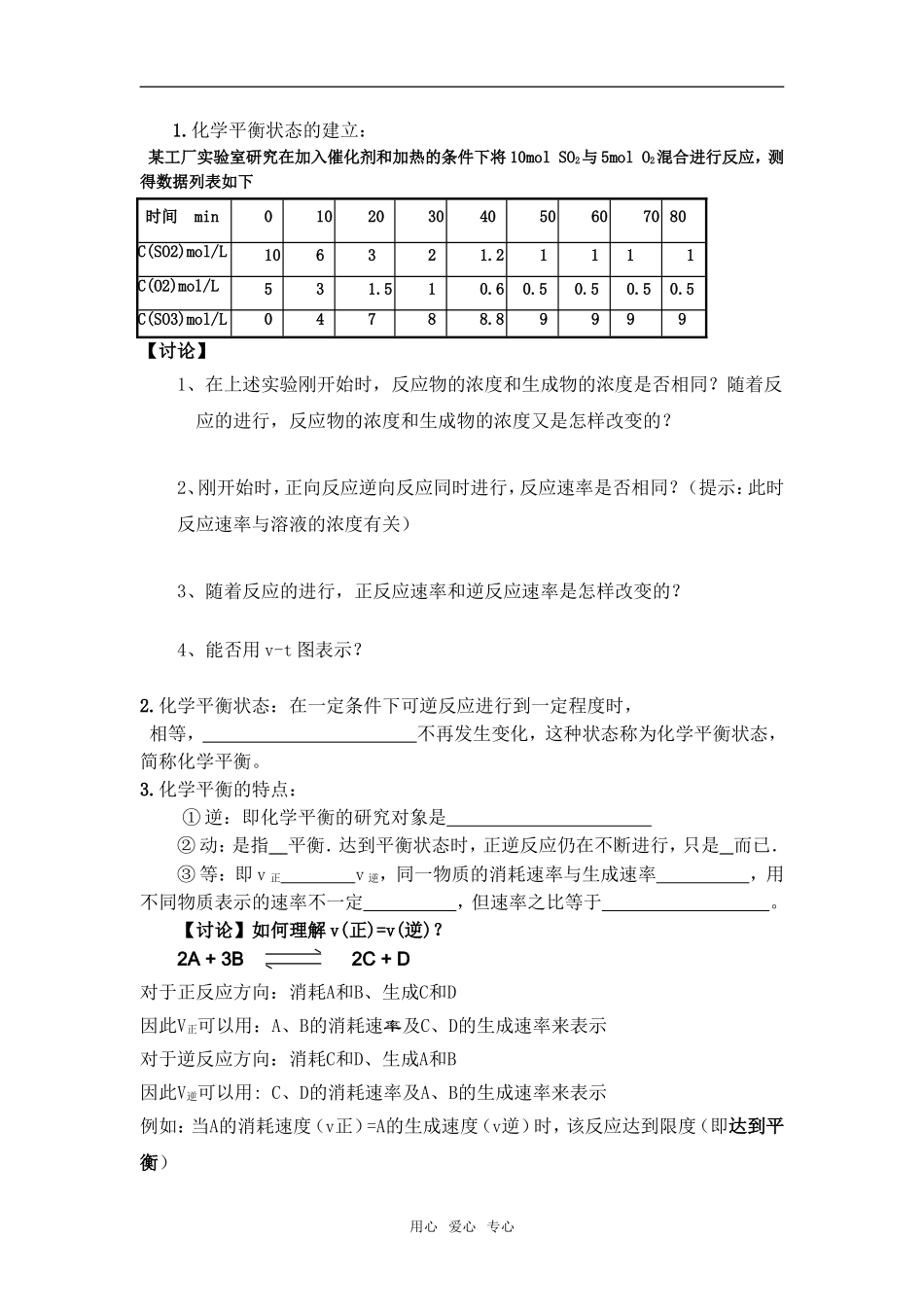
化学反应限度【学习目标】知道可逆反应、化学平衡的含义,能够设计实验证明可逆反应,能够进行化学平衡状态的判断【重、难点】化学平衡的建立【学习过程】一、可逆反应1.可逆反应: 。2.特点:用 号表示,通常把 叫正反应,把 叫逆反应。在反应体系中,与化学反应有关的所有物质共存,即可逆反应的反应物 全部转化为生成物。练习 1:判断下列反应是否为可逆反应? (课本 51 页思考与交流)①2H2+O2 点燃 2H2O 2H2O 电解 2H2↑+O2↑②SO2+H2O H2SO3 H2SO3 SO2+H2O结论:由此可知,判断可逆反应必须在 下,才能同时向 和 两个方向进行。练习 2:SO2和 O2反应生成 SO3的反应方程式表示为 ,在反应体系中存在的分子有 。练习 3.设计实验证明氯化铁溶液与碘化钾溶液的反应是否为可逆反应,并进行实验。FeCl3溶液与KI溶液反应 是否可逆的实验验证实验现象 结论 ①FeCl3 溶 液 与 稍 过量 KI 溶液反应 ② 在反应①的溶液中加入 CCl4,振荡、静置 ③ 取②的上层清液,滴加 KSCN 溶液 二、化学平衡状态用心 爱心 专心1.化学平衡状态的建立: 某工厂实验室研究在加入催化剂和加热的条件下将 10mol SO2与 5mol O2混合进行反应,测得数据列表如下时间 min010203040506070 80C(SO2)mol/L106321.21 11 1C(O2)mol/L531.510.60.50.5 0.50.5 C(SO3)mol/L04788.899 9 9 【讨论】1、在上述实验刚开始时,反应物的浓度和生成物的浓度是否相同?随着反应的进行,反应物的浓度和生成物的浓度又是怎样改变的? 2、刚开始时,正向反应逆向反应同时进行,反应速率是否相同?(提示:此时反应速率与溶液的浓度有关)3、随着反应的进行,正反应速率和逆反应速率是怎样改变的?4、能否用 v-t 图表示?2.化学平衡状态:在一定条件下可逆反应进行到一定程度时, 相等, 不再发生变化,这种状态称为化学平衡状态,简称化学平衡。3.化学平衡的特点:① 逆:即化学平衡的研究对象是 ② 动:是指 平衡.达到平衡状态时,正逆反应仍在不断进行,只是 而已.③ 等:即 v 正 v 逆,同一物质的消耗速率与生成速率 ,用不同物质表示的速率不一定 ,但速率之比等于 。【讨论】如何理解 v(正)=v(逆)?2A + 3B 2C + D对于正反应方向:消耗A和B、生成C和D因此V正可以用:A、B的消耗速率及C、D的生成速率来表示对于逆反应方向:消耗C和D、生成A和B 因此V逆可以用: C、D的消耗速率及A、B的生成速率来表...