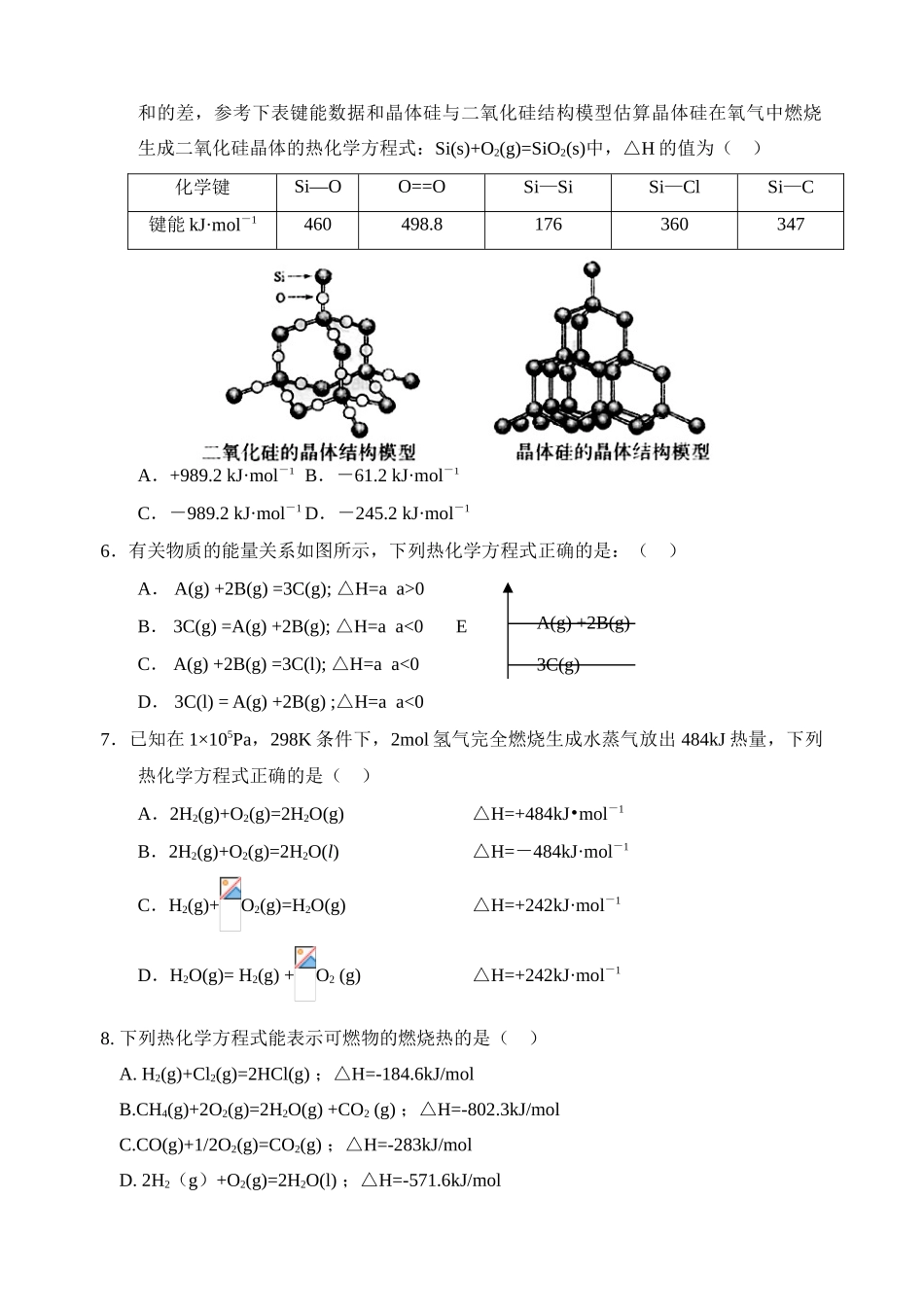
课题:热化学方程式热身运动1.书写下列反应的热化学方程式: ⑴在标准状况下11.2升甲烷完全燃烧生成CO2 和液态水放出444.8KJ热,其热化学方程式为( ) ⑵3克红热的炭和水蒸汽充分反应,生成CO2 和H2。吸收32.8KJ热,热化学方程式为( ) 2.强酸和强碱的稀溶液的中和热可表示为: H+(aq)+OH -(aq) H2O(1);△ H=-57.3kJ/mol。已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1);△H=-Q1kJ/mol1/2H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(1); △H=-Q2kJ/molHNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(1); △H=-Q3kJ/mol则 Q1、Q2、Q3的关系正确的是 ( )A.Q3>Q2>Q1B.Q1>Q3>Q2C.Q1=Q2=Q3D.Q2>Q3>Q13.已知热化学方程式:① H2(g)+O2(g)=H2O(g); △H=-241.8kJ·mol-1 ②2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ·mol-1③H2(g)+ O2(g)=H2O(1); △H=-285.8kJ·mol-1④2H2(g)+O2(g)=2H2O(1); △H=-571.6kJ·mol-1 则氢气的燃烧热为( )A.241.8kJ·mol-1 B.483.6kJ·mol-1C.285.8kJ·mol-1D.571.6kJ·mol-14.已知下列热化学方程式Zn(s)+1/2O2=ZnO(s),△H=-351.1KJ/mol,Hg(L)+1/2O2 (g)=HgO(s), △H=-90.7KJ/mol 由此可知反应Zn(s)+HgO(s) =ZnO(s)+Hg(L)的△H为( )A -1441.8KJ/mol B 260.4KJ/mol C +441KJ/mol D -260.4KJ/mol小结热化学方程式意义及书写方法:几组概念: 反应热的计算:你复习中遇到的疑惑有__________________________________________真枪实弹(高考真题)1.下列说法正确的是( )A.化学反应中的能量变化,都表现为热量的变化B.需要加热才能发生的反应,一定是吸热反应C.放热反应在常温下一定很容易发生D.是吸热反应还是放热反应,必须看反应物的总能量和生成物的总能量的相对大小2.已知由石墨制备金刚石的反应为:C(石墨)======= C(金刚石);△H=>0则下列两个反应中:C(石墨)+O2(g)=CO2(g); △H=-akJ·mol-1 ;C(金刚石)+O2(g)=CO2(g); △H=-bkJ·mol-1 。 则 a 与 b 的关系为( )A.a>bB.a