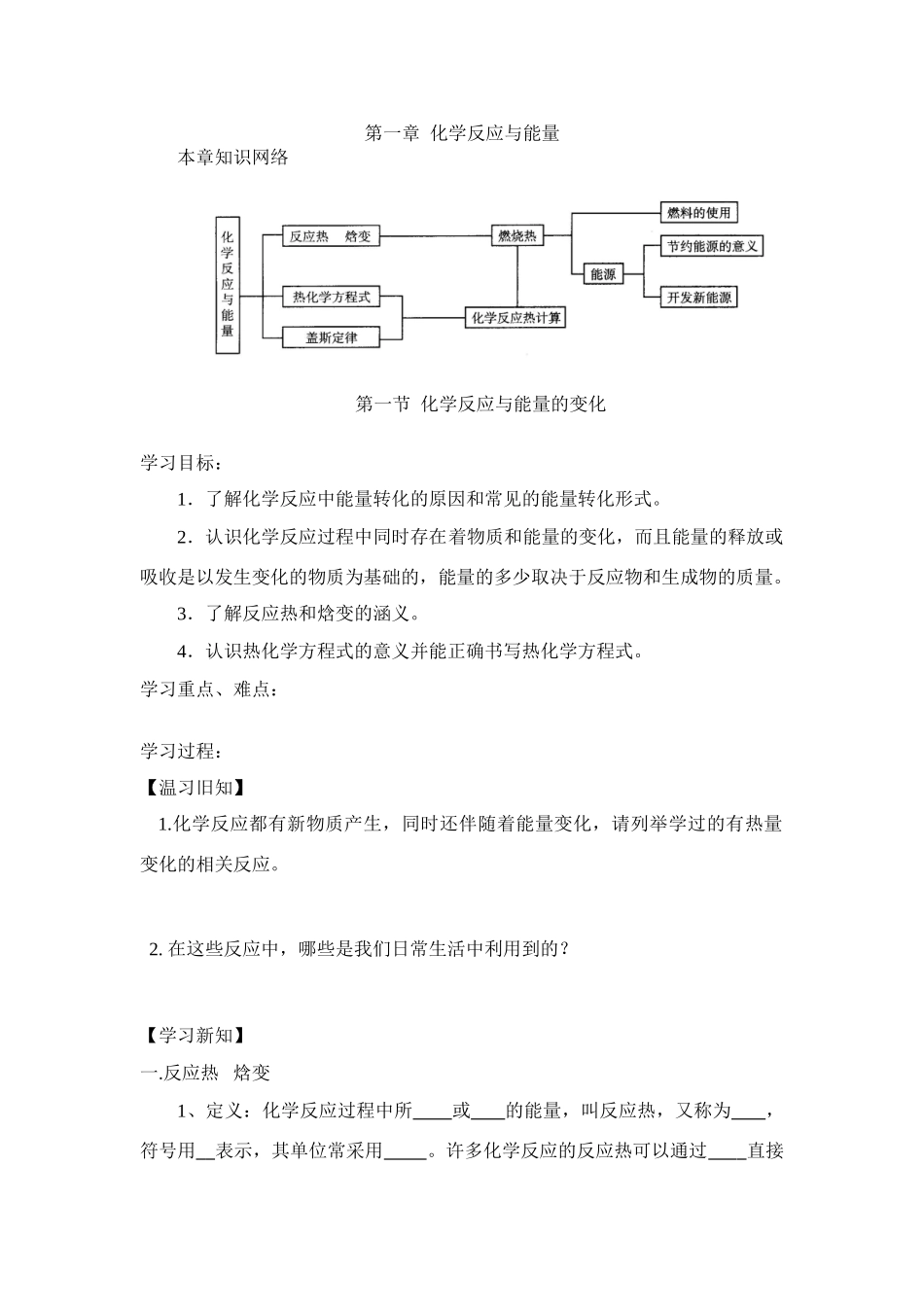
第一章 化学反应与能量本章知识网络 第一节 化学反应与能量的变化学习目标:1.了解化学反应中能量转化的原因和常见的能量转化形式。2.认识化学反应过程中同时存在着物质和能量的变化,而且能量的释放或吸收是以发生变化的物质为基础的,能量的多少取决于反应物和生成物的质量。3.了解反应热和焓变的涵义。4.认识热化学方程式的意义并能正确书写热化学方程式。学习重点、难点: 学习过程:【温习旧知】1.化学反应都有新物质产生,同时还伴随着能量变化,请列举学过的有热量变化的相关反应。2. 在这些反应中,哪些是我们日常生活中利用到的?【学习新知】 一.反应热 焓变 1、定义:化学反应过程中所 或 的能量,叫反应热,又称为 ,符号用 表示,其单位常采用 。许多化学反应的反应热可以通过 直接测量。2、 化学反应中能量变化的原因化学反应的本质是 。任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子间的化学键 ___时,需要 _的相互作用,这需要 能量;当 ,即新化学键 时,又要 能量 。如果反应完成时,生成物释放的总能量比反应物吸收的总能量 ,这是放热反应。对于放热反应,由于反应后放出能量(释放给环境)而使反应体系的能量 。因此,规定放热反应的 ΔH 为“_ ”。反之,对于吸热反应,由于反应通过 、 等吸收能量(能量来自环境)而使反应体系的能量 。因此,规定吸热反应的 ΔH 为“ ”。当 ΔH 为“___ __”或 ΔH 0 时,为放热反应;当 ΔH 为“_ _”或 ΔH_ __0 时,为吸热反应。3、放热反应与吸热反应比较类型比较 放热反应吸热反应定 义形 成原因与 化学 键强 弱的 关系表 示方法图 示二、热化学方程式1、 化学方程式,叫做热化学方程式。热化学方程式不仅表明了化学反应中的 变化,也表明了化学反应中的 变化。2、H2(g)+O2(g)===H2O(l) ; ΔH=-285.8 kJ·mol-1,表示在 ℃,_ Pa, mol H2 与 mol O2 完全反应生成 态水时 的热量是 285.8 kJ。(3)热化学方程式各物质前的化学计量数只表示 不表示 ,因此,它可以是 _ 数,也可以是 数。对于相同物质的反应,当化学计量数不同时,其 ΔH 。小结:书写热化学方程式的注意事项① 标聚集状态(s、l、g)② 右端标热量数值和符号, H△:吸热用“ ”,放热用:“ ”。③ 系数单位是“ ”,而不是“ ”。④ 系数可用分数,但热量值要相应变化。如:2H2(g)+O2(g)=2H2O...