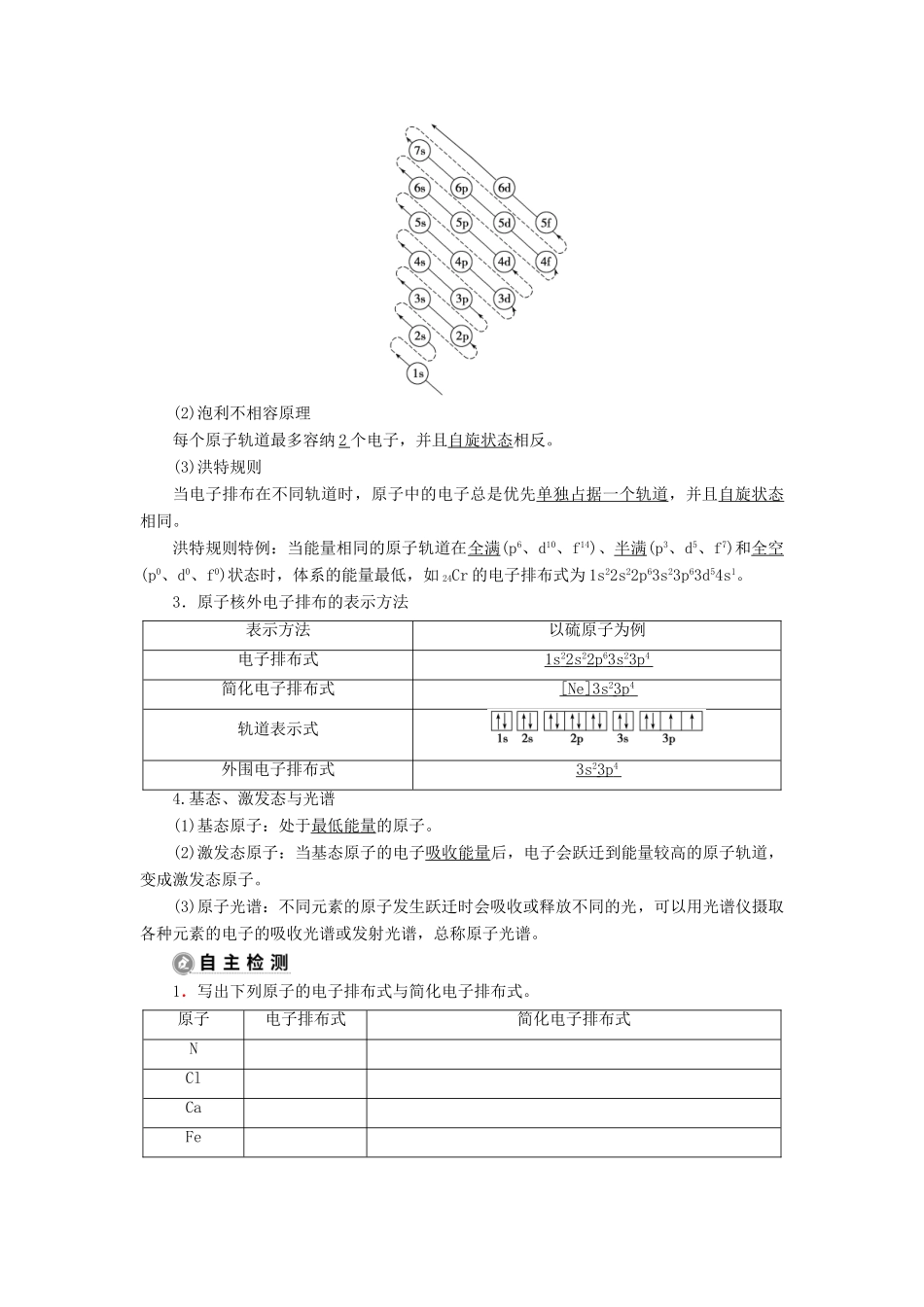
第一单元 原子结构与元素的性质学习任务 1 原子核外电子的排布1.核外电子的排布特征(1)电子云用小点的疏密来描述电子在原子核外空间出现的机会的大小所得到的图形。(2)电子层(又称为能层)① 在多电子原子中,核外电子的能量是不同的。能量不同的电子在核外不同的区域内运动,这种不同的区域称为电子层。② 习 惯 上 人 们 用 英 文 字 母 n 表 示 电 子 层 。 原 子 中 由 里 向 外 的 电 子 层 数 可 取1、2、3、4、5 等正整数,对应的电子层符号分别为 K 、 L 、 M 、 N 、 O 等。每一电子层最多容纳的电子数为 2 n 2 。③ 离核越近的电子层,能量越低。不同电子层的能量是不连续的。(3)原子轨道(又称为能级)① 在多电子原子中,同一电子层的电子,能量也可能不同,不同能量的电子分占在不同的原子轨道,不同形状的原子轨道分别用 s 、 p 、 d 、 f 表示。② 原子轨道有不同的形状:s 轨道呈球形,p 轨道呈纺锤形,d 轨道和 f 轨道较复杂。形状相同的原子轨道在原子核外空间还有不同的伸展方向。2.原子核外电子排布的原理(1)能量最低原理电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。如图为原子核外电子排布的轨道能量顺序图。(2)泡利不相容原理每个原子轨道最多容纳 2 个电子,并且自旋状态相反。(3)洪特规则当电子排布在不同轨道时,原子中的电子总是优先单独占据一个轨道,并且自旋状态相同。洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如 24Cr 的电子排布式为 1s22s22p63s23p63d54s1。3.原子核外电子排布的表示方法表示方法以硫原子为例电子排布式1s 2 2s 2 2p 6 3s 2 3p 4 简化电子排布式[Ne]3s 2 3p 4 轨道表示式外围电子排布式3s 2 3p 4 4.基态、激发态与光谱(1)基态原子:处于最低 能量 的原子。(2)激发态原子:当基态原子的电子吸收能量后,电子会跃迁到能量较高的原子轨道,变成激发态原子。(3)原子光谱:不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。1.写出下列原子的电子排布式与简化电子排布式。原子电子排布式简化电子排布式NClCaFeCu答案:原子电子排布式简化电子排布式N1s22s22p3[He]2s22p3Cl1s22s22p63s23p5[Ne]3s23p5Ca1s22s22p...