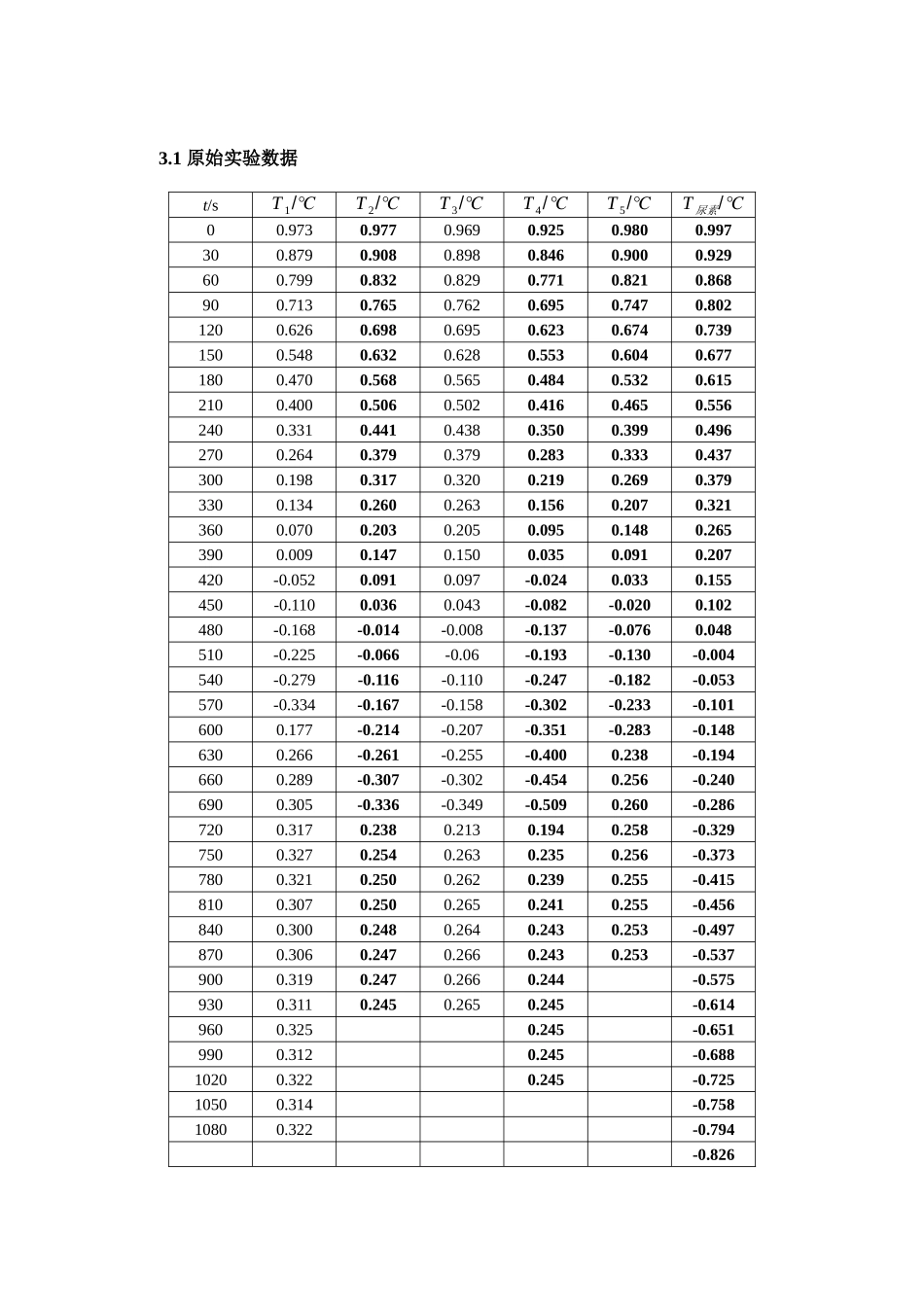
凝固点降低法测定摩尔质量宋予晴/2025030014 生 14 周小玉实验日期:20250413,提交报告日期:2025041x李琛1 引言(简明的实验目的/原理)【1】1.1 实验目的:1)用凝固点降低法测定尿素的摩尔质量2)学会用不冷曲线对溶液凝固点进行校正3)通过本实验加深对稀溶液依数性的认识1.2 实验原理:稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为:ΔT f=T f*−T f=Kf×bB式中ΔT f为凝固点降低值;T f*、T f分别为纯溶剂、溶液的凝固点;bB为溶液的质量摩尔浓度,Kf为凝固点降低常数。假如稀溶液是由质量为mB的溶质溶于质量为m A的溶剂中而构成,则上式可写为:ΔT f= Kf×103mBM B×mA即M B=K f⋅103mBΔT fm A式中Kf为溶剂的凝固点降低常数(单位为K ⋅ kg⋅mol−1);M B为溶质的摩尔质量(单位为g⋅ mol−1)。假如已知溶液的Kf值,则可通过实验测出溶液的凝固点降低值ΔT f,利用上式即可求出溶质的摩尔质量。本实验中用到的溶剂水的Kf=1.853 K ∙kg∙mol−1实验中,要测量溶剂和溶液的凝固点之差。对于纯溶剂如下图(a)所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故晶体并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。对于纯溶剂来说,在一定压力下,凝固点式固定不变的,直到全部液体凝固成固体后才会下降。相对恒定的温度即为凝固点。对于溶剂来说,除温度外还有溶液浓度的影响。当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。因此,凝固点不是一个恒定的值如把回升的最高点温度作为凝固点,这是由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。要精确测量,应测出步冷曲线,如图(b)所示方法,外推至T f校正。2 实验操作2.1 实验药品、仪器型号及测试装置示意图数字温度/温差计(-12-12℃,0.001℃),冷阱,大试管,移液管(25mL),磁力搅拌器,可制冷超级恒温槽(-20-100℃),分析天平。 实验装置图蒸馏水,尿素2.2 实验条件(实验温度、湿度、压力等)室温、标准大气压2.3 实验操作步骤及方法要点【2】3 结果与讨论 3.1 原始实验数据t/sT 1/℃T 2/℃T 3/℃T 4/℃T 5/℃T 尿素/℃00.9730.9770.9690.9250.9800.997300.8790.9080.8980.8460.9000.929600.7990.8320.8290.7710.8210.868900.7...