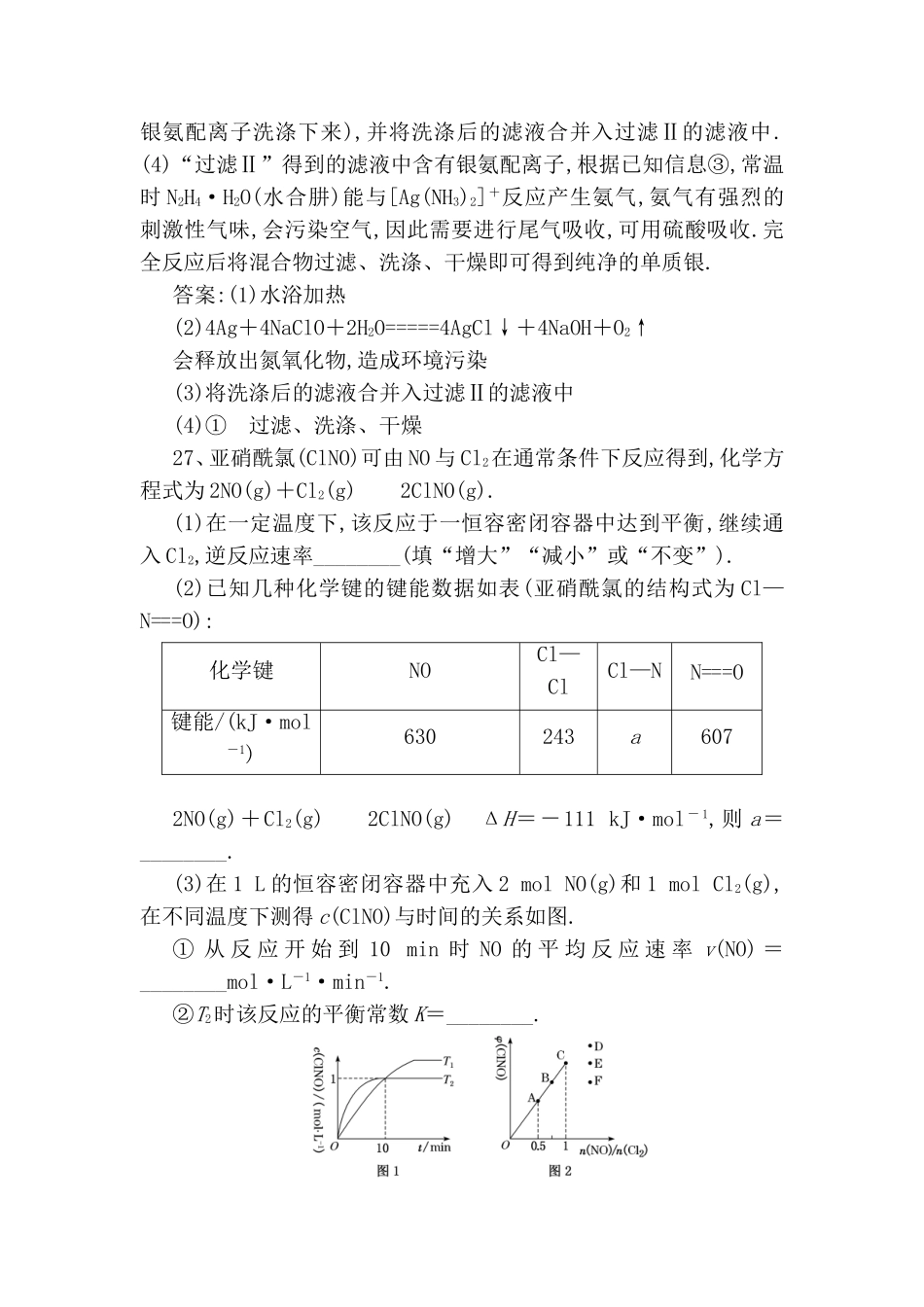
第二周非选择题增分练26、某科研小组采用如下方案回收废旧光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略).已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO===2NaCl+NaClO3②AgCl可溶于氨水:AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O③常温时N2H4·H2O(水合肼)能还原[Ag(NH3)2]+:4[Ag(NH3)2]++N2H4·H2O===4Ag↓+N2↑+4NH+4NH3↑+H2O(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为________.(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________________________________________________________________________.HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是_________________________________________________________________________________.(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并________________.(4)从“过滤Ⅱ”得到的滤液中获取单质Ag的过程中,在加入2mol·L-1水合肼溶液后,后续还需选用的试剂有________(①1mol·L-1H2SO4溶液、②10%氨水、③1mol·L-1NaOH溶液,填序号).反应完全后欲获取纯净的单质银需再进行的实验操作为________________________________________________________________________.解析:(1)控制反应温度为80℃,可以选择水浴加热.(2)根据得失电子守恒、原子守恒配平化学方程式.HNO3也能氧化Ag,硝酸作氧化剂时通常被还原为有毒的氮氧化物而污染环境.(3)为提高Ag的回收率,需对过滤Ⅱ的滤渣进行洗涤(洗涤的目的是把滤渣表面残留的银氨配离子洗涤下来),并将洗涤后的滤液合并入过滤Ⅱ的滤液中.(4)“过滤Ⅱ”得到的滤液中含有银氨配离子,根据已知信息③,常温时N2H4·H2O(水合肼)能与[Ag(NH3)2]+反应产生氨气,氨气有强烈的刺激性气味,会污染空气,因此需要进行尾气吸收,可用硫酸吸收.完全反应后将混合物过滤、洗涤、干燥即可得到纯净的单质银.答案:(1)水浴加热(2)4Ag+4NaClO+2H2O=====4AgCl↓+4NaOH+O2↑会释放出氮氧化物,造成环境污染(3)将洗涤后的滤液合并入过滤Ⅱ的滤液中(4)①过滤、洗涤、干燥27、亚硝酰氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)2ClNO(g).(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率________(填“增大”“减小”或“不变”).(2)已知几种化学键的键能数据如表(亚硝酰氯的结构式为Cl—N===O):化学键NOCl—ClCl—NN===O键能/(kJ·mol-1)630243a6072NO(g)+Cl2(g)2ClNO(g)ΔH=-111kJ·mol-1,则a=________.(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图.①从反应开始到10min时NO的平均反应速率v(NO)=________mol·L-1·min-1.②T2时该反应的平衡常数K=________.(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图2,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,反应达到平衡状态ClNO的体积分数可能是D、E、F三点中的________点.解析:(1)该反应于恒容密闭容器中达到平衡,继续通入Cl2,平衡正向移动,c(ClNO)增大,逆反应速率增大,直至正、逆反应速率相等时反应再次达到平衡.(2)由2NO(g)+Cl2(g)2ClNO(g)ΔH=反应物总键能-生成物总键能=(2×630+243)kJ·mol-1-(2a+2×607)kJ·mol-1=(289-2a)kJ·mol-1=-111kJ·mol-1,解得a=200.(3)①反应至10min时,c(ClNO)=1mol·L-1,则v(ClNO)==0.1mol·L-1·min-1,则NO的平均反应速率v(NO)=v(ClNO)=0.1mol·L-1·min-1.②起始时c(NO)=2mol·L-1,c(Cl2)=1mol·L-1,T2下,反应达到平衡时c(ClNO)=1mol·L-1,根据2NO(g)+Cl2(g)2ClNO(g),则平衡时c(NO)=1mol·L-1,c(Cl2)=0.5mol·L-1,T2时该反应的平衡常数K===2.(4)n(NO)/n(Cl2)的值越小,NO的转化率越大,故A、B、C三状态中NO的转化率最大的是A点,n(NO)/n(Cl2)=2时,反应达到平衡状态ClNO的体积分数最大,结合题图2中曲线的变化趋势,当n(NO)/n(Cl2)=1.5时,反应达到平衡状态ClNO的体积分数...