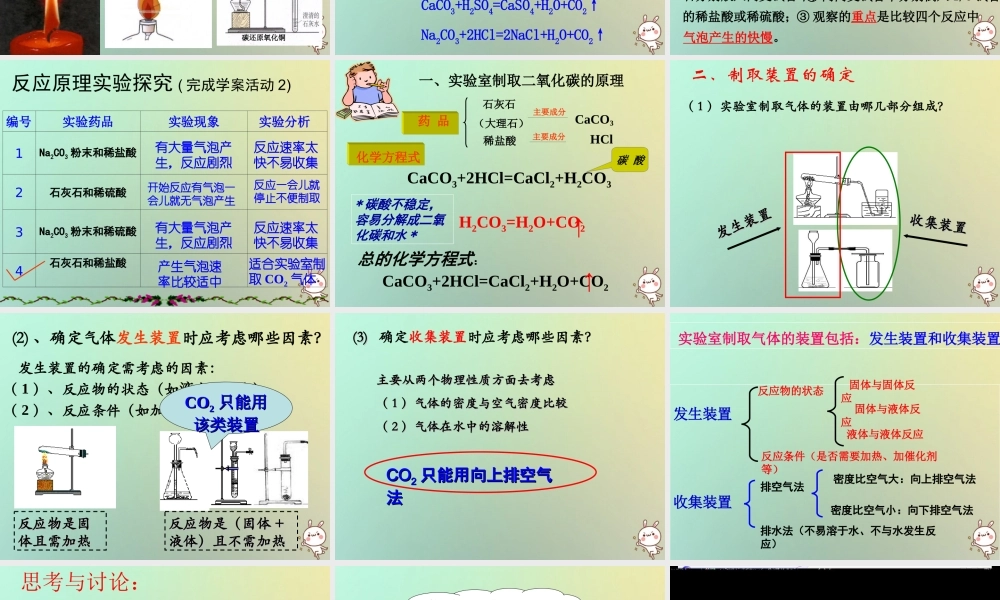
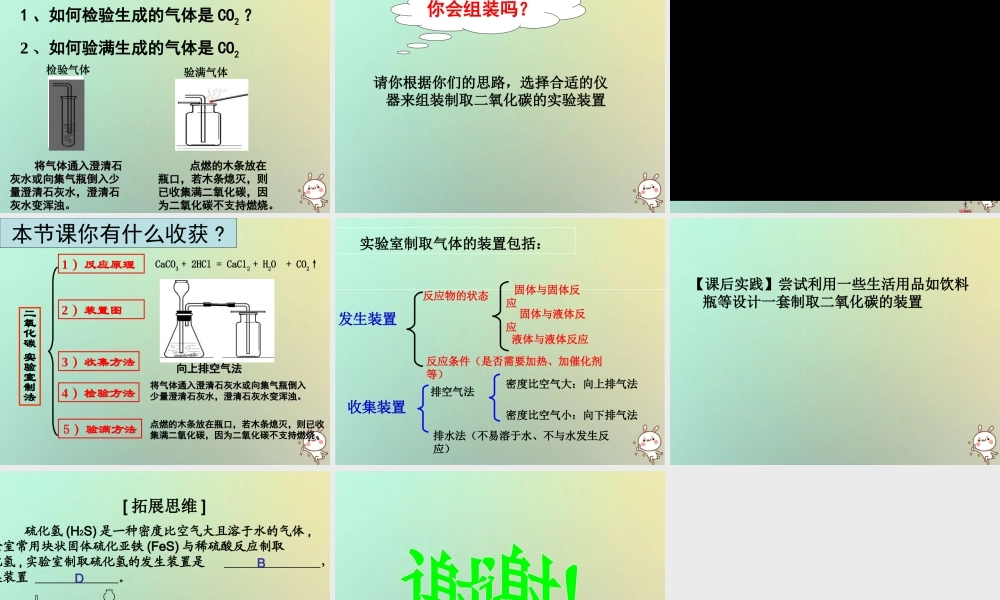
左侧月儿弯,右侧月儿圆;弯月能取暖,圆月能助燃。谜语:猜一种气体co2课题 2 二氧化碳制取的研究 教学目标:1. 了解实验室中制取二氧化碳的反应原理。2. 探究设计实验室制取二氧化碳的装置。3. 通过对二氧化碳和氧气有关性质的比较,分析装置的不同,初步确立实验室制取气体的一般思路、方法和原则。 列举你所知道的能生成二氧化碳的反应,与同学讨论这些反应能否用于在实验室里制取二氧化碳,并说明理由? ( 完成学案活动一 )提示:① 可操作性是前提② 操作是否简便易行、是否安全,原料是否廉价易得,产生的气体是否有利于收集,是否纯洁等。都有 CO2 气体产生煤燃烧木材燃烧人呼吸酒精燃烧碳还原氧化铜蜡烛燃烧探究信息:探究信息:含碳酸根离子( CO32- )的化合物(例如:碳酸钠 Na2CO3 、大理石或石灰石主要成分是 CaCO3 )能与盐酸( HCl )或稀硫酸( H2SO4 )反应生成 CO2 。其原理为: CaCO3+2HCl=CaCl2+H2O+CO2↑ CaCO3+H2SO4=CaSO4+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑探究实验一★ 药品:碳酸钠、石灰石、稀盐酸、稀硫酸。★ 仪器: 4 支试管。 ① ② ③ ④ ★ 注意:①将半药匙碳酸钠、两至三粒石灰石分别放入两支试管中;② 向两支试管中分别倒入 1/5 试管的稀盐酸或稀硫酸;③ 观察的重点是比较四个反应中气泡产生的快慢。编号实验药品实验现象 实验分析1Na2CO3 粉末和稀盐酸2石灰石和稀硫酸3Na2CO3 粉末和稀硫酸4石灰石和稀盐酸反应原理实验探究 ( 完成学案活动 2)有大量气泡产生,反应剧烈有大量气泡产生,反应剧烈产生气泡速率比较适中开始反应有气泡一会儿就无气泡产生反应速率太快不易收集适合实验室制取 CO2 气体反应速率太快不易收集反应一会儿就停止不便制取一、实验室制取二氧化碳的原理石灰石(大理石)稀盐酸主要成分主要成分CaCO3HCl药 品化学方程式碳 酸CaCO3+2HCl=CaCl2+H2O+CO2总的化学方程式:CaCO3+2HCl=CaCl2+H2CO3* 碳酸不稳定,容易分解成二氧化碳和水 *H2CO3=H2O+CO2↑↑( 1 )实验室制取气体的装置由哪几部分组成?发生装置发生装置收集装置收集装置二、制取装置的确定(2) 、确定气体发生装置时应考虑哪些因素? 发生装置的确定需考虑的因素:( 1 )、反应物的状态(如液态、固态)( 2 )、反应条件(如加热,不加热)反应物是固反应物是固体且需加热体且需加热反应物是(固体反应物是(固体 ++液体)且不需加热液体)且不需加热...