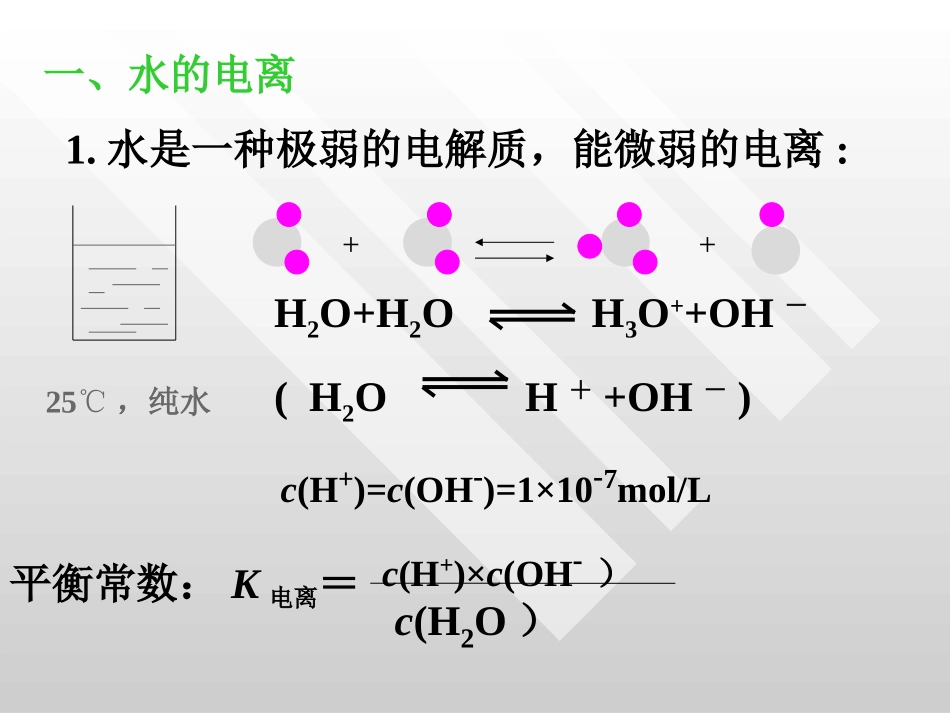
第二节第二节水的电离和溶液的酸碱性水的电离和溶液的酸碱性一、水的电离二、溶液的酸碱性与pH三、pH的应用一、水的电离1.水是一种极弱的电解质,能微弱的电离:25℃,纯水++H2O+H2OH3O++OH-(H2OH++OH-)c(H+)=c(OH-)=1×10-7mol/L平衡常数:K电离=c(H+)×c(OH-)c(H2O)•1L1L纯水的物质的量是纯水的物质的量是5555··6mol6mol,经实验测,经实验测得得252500CC时,发生电离的水只有时,发生电离的水只有1×101×10-7-7molmol,,二者相比,水的电离部分太小,可以忽略不二者相比,水的电离部分太小,可以忽略不计。因此电离前后水的物质的量几乎不变,计。因此电离前后水的物质的量几乎不变,可以视为常数,常数乘以常数必然为一个新可以视为常数,常数乘以常数必然为一个新的常数,用的常数,用KKww表示,即为水的离子积常数,表示,即为水的离子积常数,简称水的离子积。简称水的离子积。在一定温度时:c(H+)×c(OH-)=Kw,叫水的离子积25℃时,Kw=1×10-142.水的离子积水的浓度为常数,所以KW=c(H+)×c(OH-)提问:根据前面所学知识,水的离子积会受什么外界条件影响?KW叫做水的离子积常数,简称水的离子积。特别提示:此时的c(H+)和c(OH-)是溶液中的总量。KW只是温度的函数(与浓度无关)温度升高,KW值增大如:KW25℃=10-14KW100℃=10-12分析下表中的数据有何规律,并解释之讨论:温度0℃20℃25℃50℃100℃Kw1.14×10-156.81×10-151×10-145.47×10-141×10-12结论:温度越高,Kw越大,水的电离是一个吸热过程水是一种极弱的电解质(通常的电流表无法检验其中离子)注意注意::1.1.任何水溶液中任何水溶液中HH++和和OHOH--总是同时存在的总是同时存在的,,只是相对含量不同只是相对含量不同..2.2.常温下常温下,,任何稀的水溶液中任何稀的水溶液中cc(H(H++)×)×cc(OH(OH--)=1×10)=1×10--14143.3.不论是在中性溶液还是在酸碱性溶液,水电不论是在中性溶液还是在酸碱性溶液,水电离出的离出的cc(H(H++))==cc(OH(OH--))4.4.根据根据KKww==cc(H(H++)×)×cc(OH(OH--))在特定温度下为在特定温度下为定值定值,,cc(H(H++))和和cc(OH(OH——))可以互求可以互求..练习练习1.0.1mol/L1.0.1mol/L的盐酸溶液中水电离出的的盐酸溶液中水电离出的cc(H(H++))和和cc(OH(OH--))是多少是多少??水电离出的水电离出的cc(OH(OH--)=1×10)=1×10-14-14/0.1=1×10/0.1=1×10-13-13mol/Lmol/L==cc(H(H++))2.2.0.1mol/L0.1mol/L的的NaOHNaOH溶液中水电离出的溶液中水电离出的cc(H(H++))和和cc(OH(OH--))是多少是多少??水电离出的水电离出的cc(OH(OH——)=1×10)=1×10-14-14/0.1=1×10/0.1=1×10-13-13mol/Lmol/L==cc(H(H++))33..常温下,在常温下,在0.1mol·L0.1mol·L--11CHCH33COOHCOOH溶液中,水的离溶液中,水的离子积是子积是()()AA..1×101×10--1414BB..1×101×10--1313..CC..1.32×101.32×10--1414DD..1.32×101.32×10--1515..4.4.能影响水的电离平衡,并使溶液中的能影响水的电离平衡,并使溶液中的cc(H(H++))>>cc(OH(OH--))的操作是的操作是()()AA.向水中投入一小块金属钠.向水中投入一小块金属钠..BB.将水加热煮沸.将水加热煮沸..CC.向水中通入二氧化碳气体.向水中通入二氧化碳气体..DD.向水中加食盐晶体.向水中加食盐晶体AC•5.5.根据电解质在水中的电离程度,可以将电解质根据电解质在水中的电离程度,可以将电解质分为分为和和。强酸、强碱和大多数的盐都是。强酸、强碱和大多数的盐都是,它们在水中,它们在水中;弱酸、弱碱和水等都是;弱酸、弱碱和水等都是,它们在水中,它们在水中,存在着,存在着。。强电解质强电解质弱电解质弱电解质全部电离成离子部分电离成离子电离平衡目录二、溶液的酸碱性与二、溶液的酸碱性与pHpH思考与交流思考与交流1.1.稀酸或稀碱电离时,发生电离的水是否仍稀酸或稀碱电离时,发生电离的水是否仍为纯水状态时的为纯水状态时的1×101×10——77??酸或碱电离出来的酸或碱电离出来的HH++或或OHOH——都会都会抑制水的电离,使水电离出来的抑制水的电离,使水电离出来...