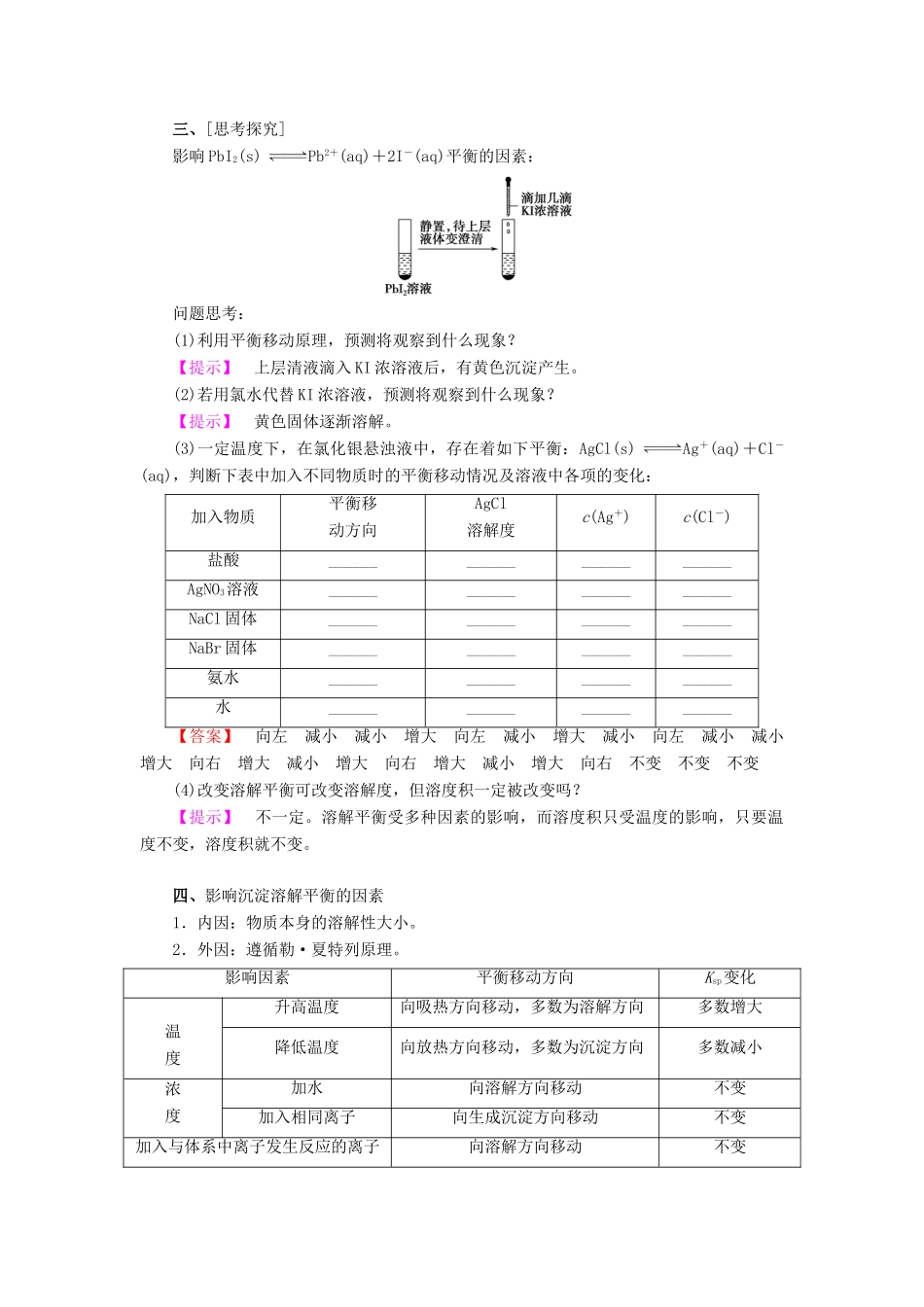
第三章物质在水溶液中的行为第3节沉淀溶解平第1课时衡【教学目标】1.知识与技能:关注难溶电解质在水溶液中的化学行为,初步运用平衡移动原理,认识沉淀溶解平衡的主要特征,理解Ksp的含义及其初步应用。2.过程与方法:通过学生提问、讨论和总结,结合实验探究,认识难溶电解质在水溶液中的化学行为,在对沉淀的生成、溶解和转化体验及分析中认识难溶电解质(沉淀)溶解平衡的主要特征学会从离子浓度积Qc与溶度积Ksp大小关系上判断沉淀溶解平衡的移动方向,培养学生分析问题、解决问题的能力。3.情感、态度与价值观:通过探究活动,让学生体验沉淀溶解平衡状态的存在及其移动方向的确定方法,树立对立统一的思想,激发求知的兴趣和求真求是的态度。培养学生学会探究、思考、合作、交流、创新的品质。【教学过程】一、沉淀溶解平衡1.概念在一定条件下,当难溶固体溶解的速率与离子结合成难溶固体的速率相等时,溶液中离子浓度、固体的量保持不变的状态。2.特点(1)动:沉淀溶解平衡是一种动态平衡。(2)等:v(沉淀)=v(溶解)≠0。(3)定:平衡时,离子浓度不变,固体的量不变。(4)变:改变影响平衡的条件,平衡被破坏,会发生沉淀的溶解、生成或转化。3.表示方法如PbI2的沉淀溶解平衡,可表示为PbI2(s)Pb2+(aq)+2I-(aq)。二、溶度积常数1.定义在一定条件下,难溶物质的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫做溶度积常数或溶度积,符号为Ksp。2.表达式以PbI2沉淀溶解平衡为例:PbI2(s)Pb2+(aq)+2I-(aq),Ksp=[Pb2+][I-]2。3.意义溶度积(Ksp)反映了难溶电解质在水中的溶解能力。对于阴阳离子个数比相同的弱电解质,Ksp的数值越大,电解质在水中的溶解能力越强。4.影响因素:Ksp只与难溶电解质的性质和温度有关,与沉淀的量和溶液中离子的浓度无关。三、[思考探究]影响PbI2(s)Pb2+(aq)+2I-(aq)平衡的因素:问题思考:(1)利用平衡移动原理,预测将观察到什么现象?【提示】上层清液滴入KI浓溶液后,有黄色沉淀产生。(2)若用氯水代替KI浓溶液,预测将观察到什么现象?【提示】黄色固体逐渐溶解。(3)一定温度下,在氯化银悬浊液中,存在着如下平衡:AgCl(s)Ag+(aq)+Cl-(aq),判断下表中加入不同物质时的平衡移动情况及溶液中各项的变化:加入物质平衡移动方向AgCl溶解度c(Ag+)c(Cl-)盐酸________________________AgNO3溶液________________________NaCl固体________________________NaBr固体________________________氨水________________________水________________________【答案】向左减小减小增大向左减小增大减小向左减小减小增大向右增大减小增大向右增大减小增大向右不变不变不变(4)改变溶解平衡可改变溶解度,但溶度积一定被改变吗?【提示】不一定。溶解平衡受多种因素的影响,而溶度积只受温度的影响,只要温度不变,溶度积就不变。四、影响沉淀溶解平衡的因素1.内因:物质本身的溶解性大小。2.外因:遵循勒·夏特列原理。影响因素平衡移动方向Ksp变化温度升高温度向吸热方向移动,多数为溶解方向多数增大降低温度向放热方向移动,多数为沉淀方向多数减小浓度加水向溶解方向移动不变加入相同离子向生成沉淀方向移动不变加入与体系中离子发生反应的离子向溶解方向移动不变3.Ksp的数值反映了难溶电解质的溶解能力,但只有相同类型的难溶电解质才可以直接通过Ksp的数值比较离子浓度的大小;对不同类型的难溶电解质要通过Ksp与溶解度的关系式,求出溶液中的离子浓度,然后去比较。五、六、检测题1.下列对沉淀溶解平衡的描述正确的是()A.开始时,溶液中各离子浓度相等B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等[来源:Zxxk.Com]C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解2.下列有关沉淀溶解平衡的说法正确的是()A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀D.在碳酸钙的沉淀溶解平衡体系中,通...