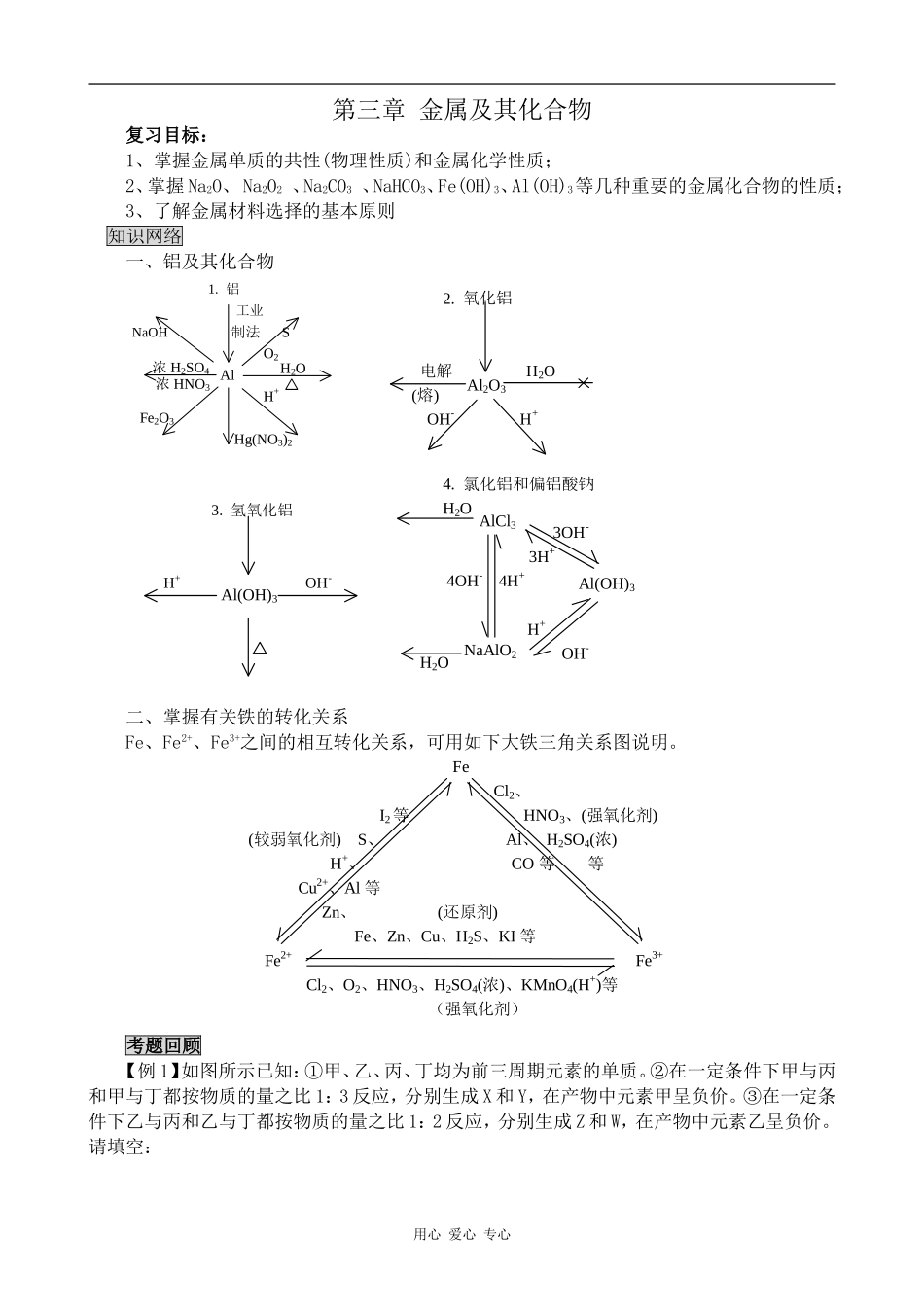
第三章金属及其化合物复习目标:1、掌握金属单质的共性(物理性质)和金属化学性质;2、掌握Na2O、Na2O2、Na2CO3、NaHCO3、Fe(OH)3、Al(OH)3等几种重要的金属化合物的性质;3、了解金属材料选择的基本原则知识网络一、铝及其化合物1.铝工业NaOH制法SO2AlH+Fe2O3Hg(NO3)2浓H2SO4浓HNO3H2O2.氧化铝电解H2O(熔)OH-H+Al2O33.氢氧化铝H+OH-Al(OH)34.氯化铝和偏铝酸钠H2O3OH-3H+4OH-4H+H+OH-AlCl3NaAlO2H2OAl(OH)3二、掌握有关铁的转化关系Fe、Fe2+、Fe3+之间的相互转化关系,可用如下大铁三角关系图说明。FeCl2、I2等HNO3、(强氧化剂)(较弱氧化剂)S、Al、H2SO4(浓)H+、CO等等Cu2+、Al等Zn、(还原剂)Fe、Zn、Cu、H2S、KI等Fe2+Fe3+Cl2、O2、HNO3、H2SO4(浓)、KMnO4(H+)等(强氧化剂)考题回顾【例1】如图所示已知:①甲、乙、丙、丁均为前三周期元素的单质。②在一定条件下甲与丙和甲与丁都按物质的量之比1:3反应,分别生成X和Y,在产物中元素甲呈负价。③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。请填空:用心爱心专心(1)甲是__________,乙是__________。(2)甲与丙反应生成X的化学方程式是__________。(3)乙与丁反应生成W的化学方程式是__________。解析:(1)由②得知,甲必为短周期中的负三价元素N或P,又由常见反应知甲只能为N。由③得知,乙必为短周期负二价元素,只有0符合。(乙为S时,分别与丙、丁反应比不为1:2)(2)丙、丁也可互换。均符合题意。1)当丙为Mg时,丁为H2。2)当丙为H2时,则丁为Mg。答案:(1)甲是N2,乙是O2。(2)N2++3MgMg3N2(或N2+3H22NH3);(3)O2+2H2=2H2O(或2Mg+O2=2MgO)。【例2】(广东高考试题)将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol/L的氢氧化钠溶液.当加入的氢氧化钠的体积V1=50mL时,开始有沉淀析出,且沉淀量随氢氧化钠的加入量逐渐增加.当氢氧化钠的体积V2=650mL时,沉淀量达到最大值,继续滴加氢氧化钠时,沉淀量逐渐减小.当时,沉淀量不再改变.(1)最初加入的50mL氢氧化钠溶液的作用是什么?(2)计算所用硫酸的浓度.(3)试判断两种氧化物各是什么,并计算其物质的量.分析:本题考察的知识点是物质的量在化学反应中的应用及两性氧化物的性质等基础化学知识和简单的推理计算能力和思维的整体性.从题目中可以得知这两种化合物都为金属氧化物,溶于酸后加入氢氧化钠50mL才开始有沉淀析出,证明硫酸是过量的.这部分氢氧化钠是来中和过量的硫酸的。当又滴入600mL氢氧化钠时金属离子完全沉淀,再加入100mL氢氧化钠时有一种金属氢氧化物沉淀恰好被溶解完,可判断该氢氧化物为氢氧化铝且物质的量为0.1mol,则氧化铝为0.05mol.所以另一种氧化物也为0.05mol,溶于酸后产生的金属离子完全沉淀时也消耗0.3mol的氢氧化钠.由此可以推出其化合价为+3价,必为三氧化二铁。解答:(1)中和过量的硫酸(2)沉淀量最大时所用OH-的物质的量与100mL强酸中H+的物质的量相等,n(OH-)=1.00mol/L×0.650L=0.650mol,故n(H+)也为0.650mol,故n(H+)也为0.650mol,硫酸的浓度为3.25mol/L。(3)由题意知,其中一种氧化物为Al2O3,根据Al(OH)3+OH=AlO2-+2H2,该反应用去的n(NaOH)=1.00mol/L×(0.750-0.650)L=0.100mol故Al(OH)3为0.100mol,而Al2O3为0.0500mol根据Al3++3OH-=Al(OH)3,生成Al(OH)3用去0.300molNaOH。而生成另一种氢氧化物也用去0.300molNaOH,且已知两种氧化物的物质的量相等,故另一种氧化物也是三价金属的氧化物,且不溶于过量碱溶液中,可知其为Fe2O3。Fe2O3的物质的量为0.0500mol点悟:本题的易错点是将50mL氢氧化钠中和的硫酸当作100mL硫酸中的全部硫酸,求出了硫酸的浓度为0.5mol/L.根据氧化物不溶于氢氧化钠认为是氧化镁或氧化铁的确定缺乏说服力,没有任何说明直接得出结论.在作题目时要言之有据.【例3】(全国理综Ⅲ,26)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进用心爱心专心行如下实验:①取适量A进行铝热反应,产物中有单质B生成;②另取20gA全部溶于0.15L6.0mol·盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,放出l.12L(标况)气体,...