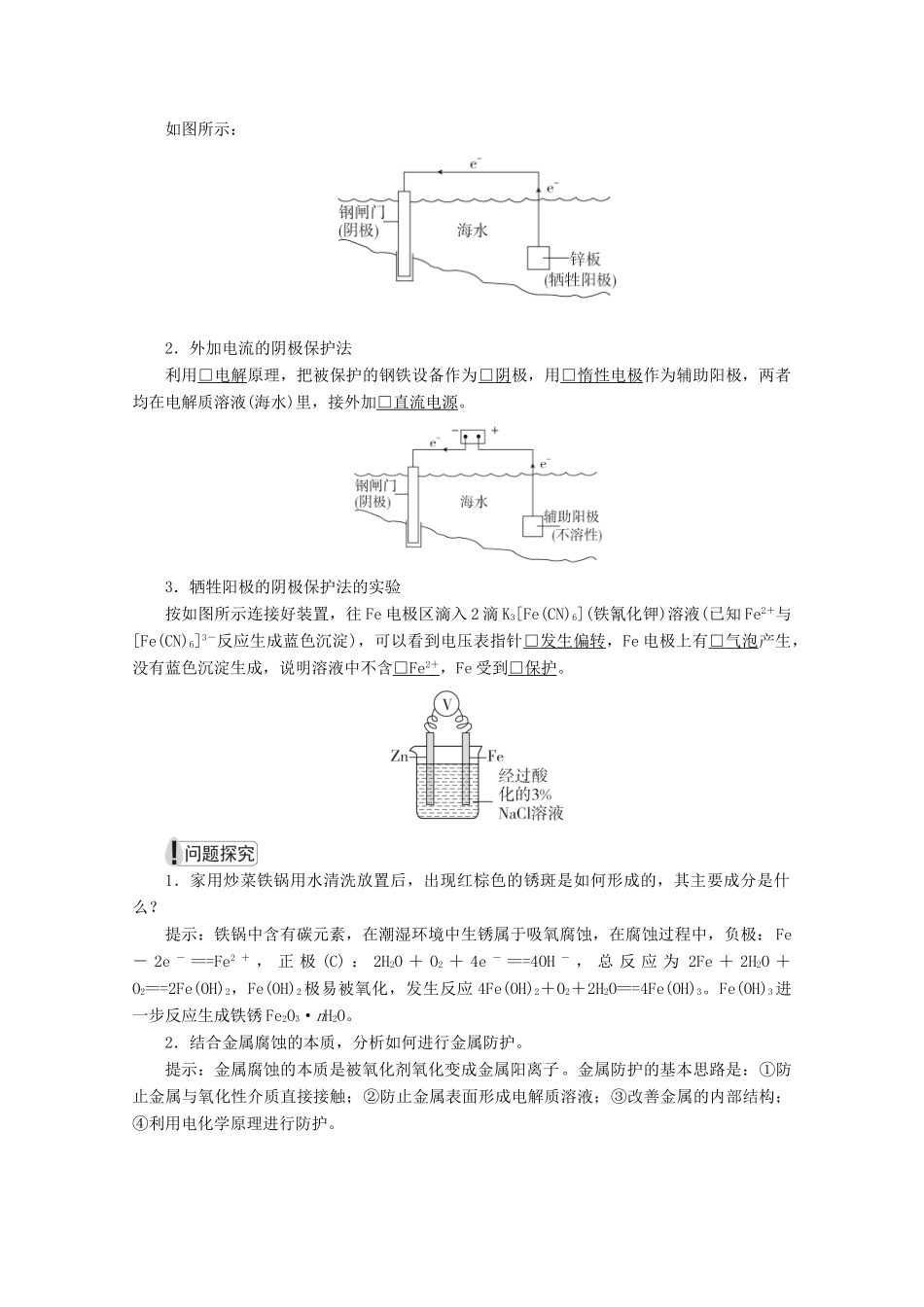
第四节金属的电化学腐蚀与防护[明确学习目标]1.了解金属腐蚀及其危害。2.了解金属电化学腐蚀的原因及反应原理。3.了解金属防护的一般方法,特别是电化学防护的方法。一、金属的电化学腐蚀1.金属的腐蚀金属腐蚀是指金属与周围的□气体或液体物质发生□氧化还原反应而引起损耗的现象。一般可分为□化学腐蚀和□电化学腐蚀。2.钢铁的电化学腐蚀二、金属的电化学防护1.牺牲阳极的阴极保护法应用□原电池原理,让被保护金属作□正极,另找一种活泼性较强的金属作□负极。如图所示:2.外加电流的阴极保护法利用□电解原理,把被保护的钢铁设备作为□阴极,用□惰性电极作为辅助阳极,两者均在电解质溶液(海水)里,接外加□直流电源。3.牺牲阳极的阴极保护法的实验按如图所示连接好装置,往Fe电极区滴入2滴K3[Fe(CN)6](铁氰化钾)溶液(已知Fe2+与[Fe(CN)6]3-反应生成蓝色沉淀),可以看到电压表指针□发生偏转,Fe电极上有□气泡产生,没有蓝色沉淀生成,说明溶液中不含□Fe2+,Fe受到□保护。1.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑是如何形成的,其主要成分是什么?提示:铁锅中含有碳元素,在潮湿环境中生锈属于吸氧腐蚀,在腐蚀过程中,负极:Fe-2e-===Fe2+,正极(C):2H2O+O2+4e-===4OH-,总反应为2Fe+2H2O+O2===2Fe(OH)2,Fe(OH)2极易被氧化,发生反应4Fe(OH)2+O2+2H2O===4Fe(OH)3。Fe(OH)3进一步反应生成铁锈Fe2O3·nH2O。2.结合金属腐蚀的本质,分析如何进行金属防护。提示:金属腐蚀的本质是被氧化剂氧化变成金属阳离子。金属防护的基本思路是:①防止金属与氧化性介质直接接触;②防止金属表面形成电解质溶液;③改善金属的内部结构;④利用电化学原理进行防护。一、金属的化学腐蚀与电化学腐蚀的比较(以铁为例)[即时练]1.铁生锈是一种常见的自然现象,其主要的化学反应方程式为:4Fe+3O2+xH2O===2Fe2O3·xH2O。如图为一放在水槽中的铁架,水位高度如图。最容易生锈的铁架横杆是()A.①B.②C.③D.④答案C解析此处铁生锈属于吸氧腐蚀。④处没有和电解质溶液接触,锈蚀速率较慢;①②③处均与电解质溶液接触,但①②处含O2较少,所以③处腐蚀最快。2.如图装置中,小试管内为红墨水,具支试管内盛有pH=5的雨水和生铁片。观察到开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是()A.生铁片中的碳是原电池的阳极,发生还原反应B.雨水酸性较强,生铁片仅发生析氢腐蚀C.红墨水回升时,碳极反应式:O2+2H2O+4e-===4OH-D.具支试管中溶液pH逐渐减小答案C解析生铁与其中的碳及电解质溶液构成原电池,负极是铁,铁失去电子发生氧化反应,碳是正极,正极发生还原反应。开始时,因酸性较强发生析氢腐蚀,一段时间后导管内液面回升且略高于小试管液面,说明具支试管中气体压强减小,此时发生吸氧腐蚀,反应式是2H2O+O2+4e-===4OH-,故溶液的pH增大,A、B、D错误;C正确。二、金属的防护1.金属的防护措施2.金属腐蚀快慢的判断方法(1)在同一电解质溶液中:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。(2)同一种金属在不同介质中腐蚀由快到慢的顺序:强电解质溶液>弱电解质溶液>非电解质溶液。(3)有无保护措施的:无保护措施的金属腐蚀>有一定保护措施的金属腐蚀>牺牲阳极的阴极保护的金属腐蚀>有外接电源的阴极保护的金属腐蚀。(4)对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。[即时练]3.如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为()A.②①③④⑤⑥B.⑤④③①②⑥C.⑤④②①③⑥D.⑤③②④①⑥答案C解析先判断装置是形成原电池还是电解池,再分析金属活动性的差别。①中Fe为负极,杂质C为正极,属于钢铁的吸氧腐蚀,腐蚀速率较慢。②、③、④实质均为原电池装置:③中Fe为正极,被保护;②、④中Fe为负极,均被腐蚀,但相对来说Fe和Cu的金属活动性差别较Fe和Sn的大,故FeCu原电池中Fe的腐蚀速率较快;⑤中Fe接电源正极作阳极,Cu接电源负极作阴极,加快了Fe的腐蚀;⑥中Fe接电源负极作阴极,Cu接电源正极作阳极,防止了Fe的腐蚀。根据以上...