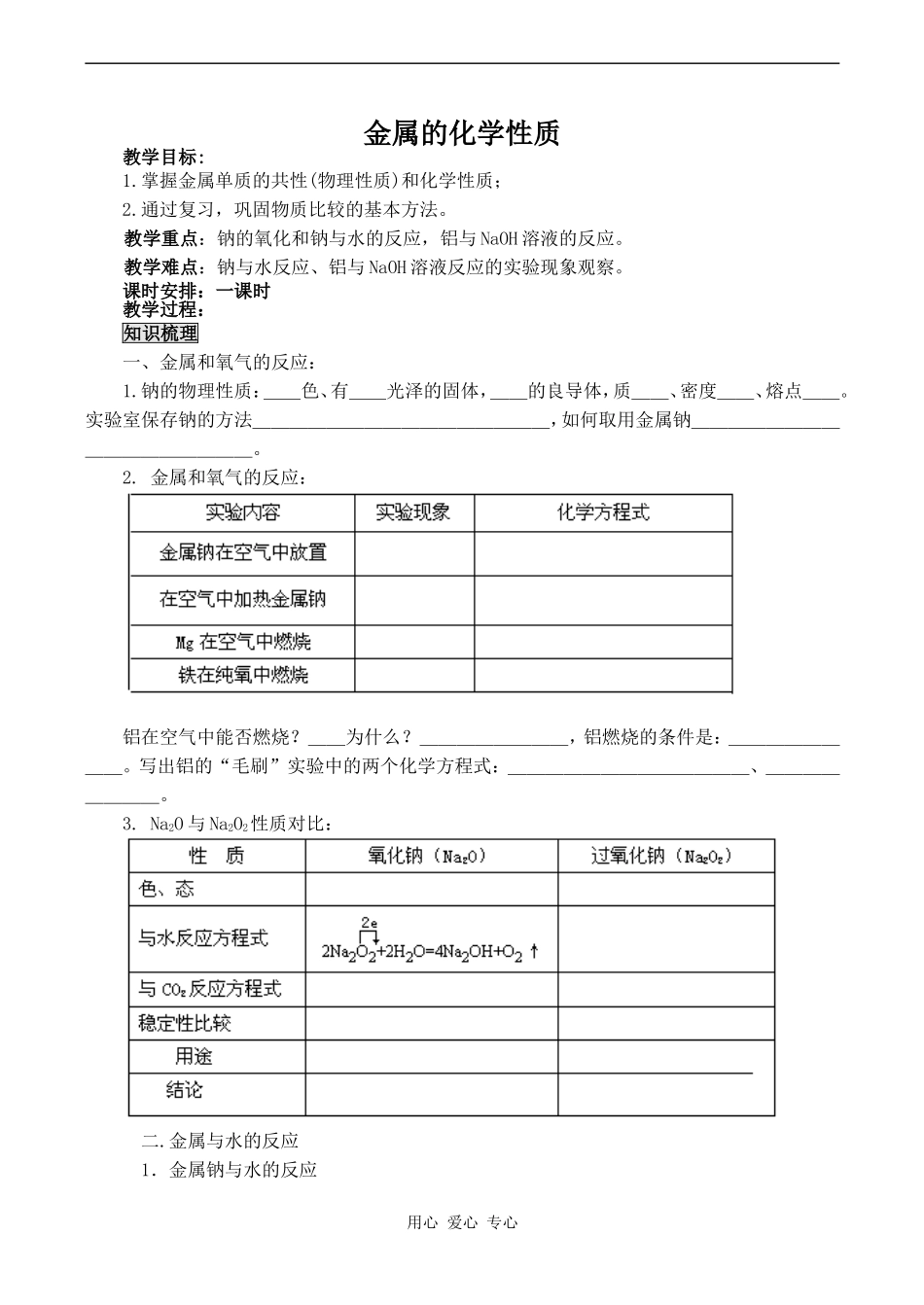
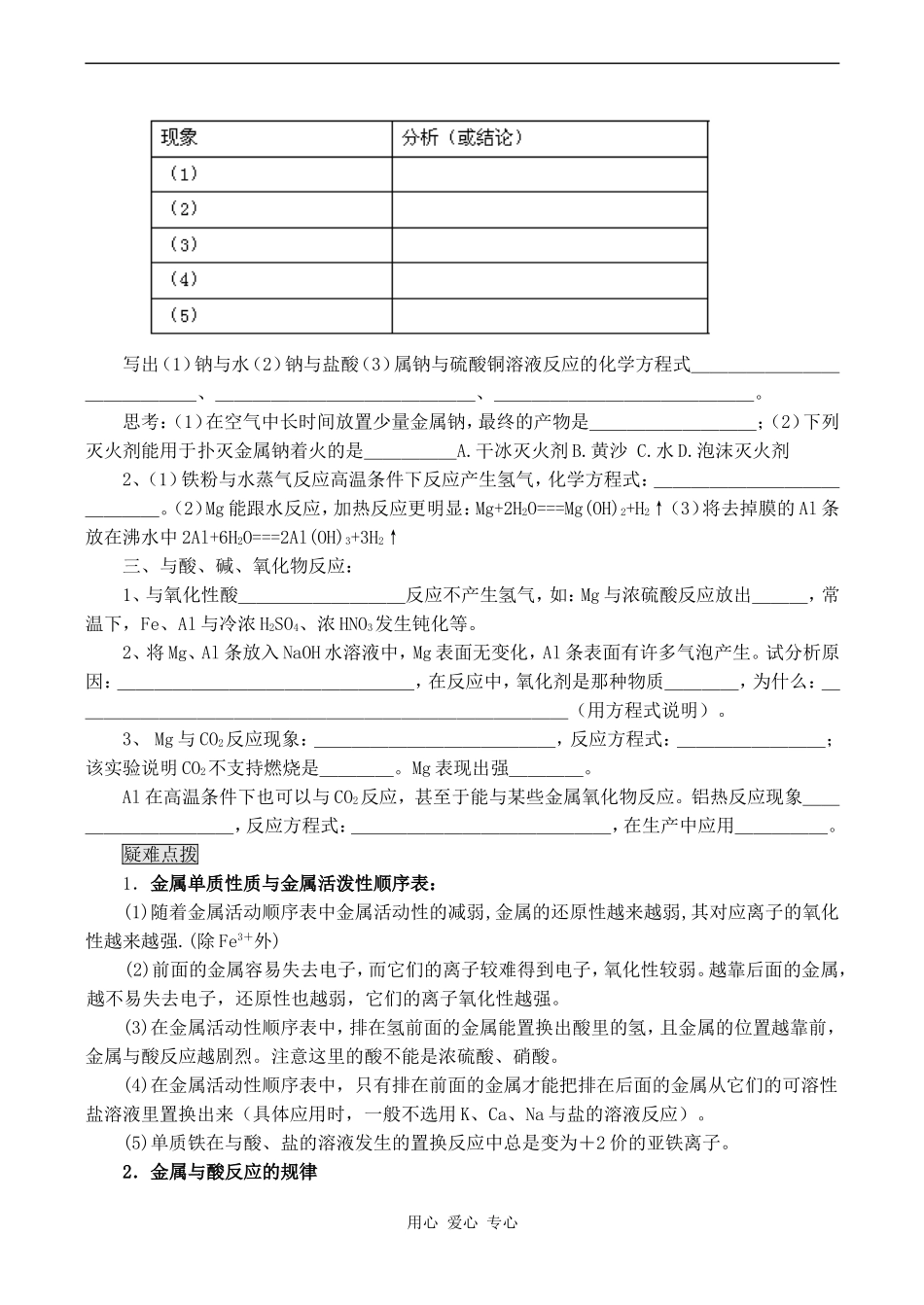
金属的化学性质教学目标:1.掌握金属单质的共性(物理性质)和化学性质;2.通过复习,巩固物质比较的基本方法。教学重点:钠的氧化和钠与水的反应,铝与NaOH溶液的反应。教学难点:钠与水反应、铝与NaOH溶液反应的实验现象观察。课时安排:一课时教学过程:知识梳理一、金属和氧气的反应:1.钠的物理性质:__色、有__光泽的固体,__的良导体,质__、密度__、熔点__。实验室保存钠的方法________________,如何取用金属钠_________________。2.金属和氧气的反应:铝在空气中能否燃烧?__为什么?________,铝燃烧的条件是:________。写出铝的“毛刷”实验中的两个化学方程式:_____________、________。3.Na2O与Na2O2性质对比:二.金属与水的反应1.金属钠与水的反应用心爱心专心写出(1)钠与水(2)钠与盐酸(3)属钠与硫酸铜溶液反应的化学方程式______________、______________、______________。思考:(1)在空气中长时间放置少量金属钠,最终的产物是_________;(2)下列灭火剂能用于扑灭金属钠着火的是_____A.干冰灭火剂B.黄沙C.水D.泡沫灭火剂2、(1)铁粉与水蒸气反应高温条件下反应产生氢气,化学方程式:______________。(2)Mg能跟水反应,加热反应更明显:Mg+2H2O===Mg(OH)2+H2↑(3)将去掉膜的Al条放在沸水中2Al+6H2O===2Al(OH)3+3H2↑三、与酸、碱、氧化物反应:1、与氧化性酸_________反应不产生氢气,如:Mg与浓硫酸反应放出___,常温下,Fe、Al与冷浓H2SO4、浓HNO3发生钝化等。2、将Mg、Al条放入NaOH水溶液中,Mg表面无变化,Al条表面有许多气泡产生。试分析原因:________________,在反应中,氧化剂是那种物质____,为什么:___________________________(用方程式说明)。3、Mg与CO2反应现象:_____________,反应方程式:________;该实验说明CO2不支持燃烧是____。Mg表现出强____。Al在高温条件下也可以与CO2反应,甚至于能与某些金属氧化物反应。铝热反应现象__________,反应方程式:______________,在生产中应用_____。疑难点拨1.金属单质性质与金属活泼性顺序表:(1)随着金属活动顺序表中金属活动性的减弱,金属的还原性越来越弱,其对应离子的氧化性越来越强.(除Fe3+外)(2)前面的金属容易失去电子,而它们的离子较难得到电子,氧化性较弱。越靠后面的金属,越不易失去电子,还原性也越弱,它们的离子氧化性越强。(3)在金属活动性顺序表中,排在氢前面的金属能置换出酸里的氢,且金属的位置越靠前,金属与酸反应越剧烈。注意这里的酸不能是浓硫酸、硝酸。(4)在金属活动性顺序表中,只有排在前面的金属才能把排在后面的金属从它们的可溶性盐溶液里置换出来(具体应用时,一般不选用K、Ca、Na与盐的溶液反应)。(5)单质铁在与酸、盐的溶液发生的置换反应中总是变为+2价的亚铁离子。2.金属与酸反应的规律用心爱心专心(1)定性规律:按金属活动性顺序表:KCaNaMgAlMnZnCrFeNiSnPb(H)CuHgAgPtAu可分为五种情况:①K→Pb和非氧化性酸(如盐酸、稀硫酸等)发生置换反应,产生H2逸出。如Fe+H2SO4====FeSO4+H2↑。②K→Pb和强氧化性酸(如硝酸、浓硫酸等)发生氧化还原反应,不能生成H2。如3Zn+4H2SO4(浓)3ZnSO4+4H2O+S↓。③Al、Fe单质遇强氧化性的浓硝酸、浓硫酸,在常温下发生钝化,形成极薄的钝化膜,保护金属不再与浓酸继续反应。④Cu→Au和强氧化性酸发生氧化还原反应,如Cu+4HNO3(浓)====Cu(NO3)2+2H2O+2NO2↑。⑤Pt→Au和强氧化剂混酸(王水)发生氧化还原反应。如Au+HNO3+3HCl====AuCl3+2H2O+NO↑。(2)定量规律①金属与酸反应失去电子的物质的量=产生氢原子的物质的量。②当参加反应的金属与产生氢气的质量差相等时,则反应后两溶液增加的质量相等。③相同物质的量的金属与足量的酸反应产生氢气的量之比等于反应后对应金属呈现的化合价之...