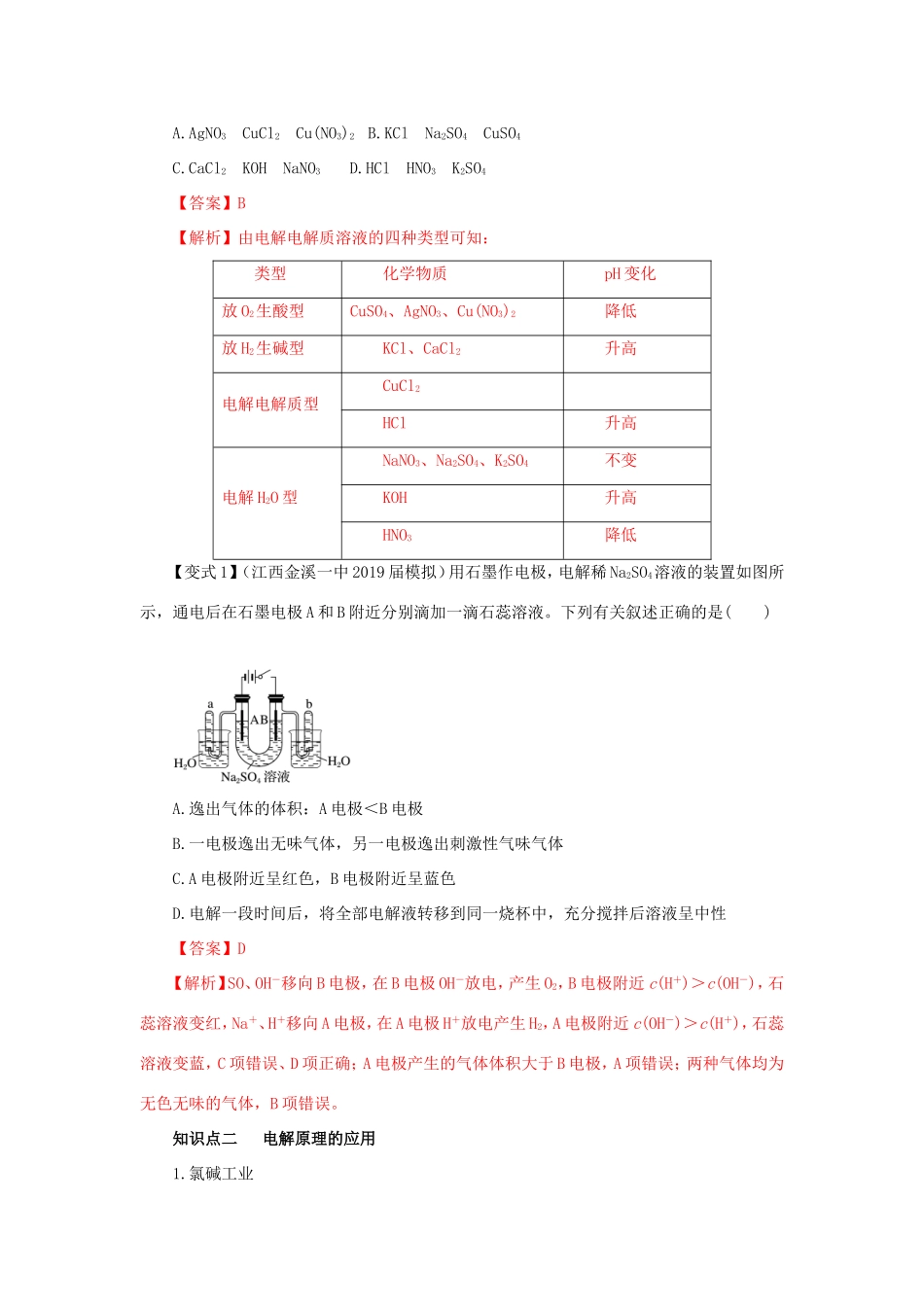
第3讲电解池金属的腐蚀与防护1.理解电解池的构成、工作原理及应用,能书写电极反应和总反应方程式。2.了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。知识点一电解的原理1.电解和电解池(1)电解:在电流作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。(2)电解池:电能转化为化学能的装置。(3)电解池的构成①有与电源相连的两个电极。②电解质溶液(或熔融电解质)。③形成闭合回路。2.电解池的工作原理(1)电极名称及电极反应式(电解CuCl2溶液为例)总反应式:CuCl2=====Cu+Cl2↑(2)电子和离子的移动方向①电子:从电源负极流出后,流向电解池阴极;从电解池的阳极流出后流向电源的正极。②离子:阳离子移向电解池的阴极,阴离子移向电解池的阳极。3.阴阳两极上放电顺序(1)阴极:(与电极材料无关)。氧化性强的先放电,放电顺序:(2)阳极:若是活性电极作阳极,则活性电极首先失电子,发生氧化反应。若是惰性电极作阳极,放电顺序为注意①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。②最常用、最重要的放电顺序为阳极:Cl->OH-;阴极:Ag+>Cu2+>H+。③电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。4.用惰性电极电解电解质溶液的规律4.用惰性电极电解电解质溶液的规律类型实例电极反应特点或反应式电解产物溶液pH变化溶液复原电解水型含氧酸H2SO4溶液中的H+和OH-分别在阴阳两极放电:阴极:4H++4e-===2H2↑阳极:4OH--4e-===2H2O+O2↑H2O2减小水强碱NaOH增大活泼金属的含氧酸盐KNO3不变电解电解质型无氧酸(氢氟酸除外)HCl电解质电离的阴阳离子分别在两极放电:阳极:2Cl--2e-===Cl2↑H2Cl2增大HCl不活泼金属的无氧酸盐CuCl2CuCl2CuCl2放氢生碱型活泼金属的无氧酸盐NaCl阴极水电离的H+放电,阳极电解质电离的阴离子放电阴极:H2阳极:Cl2增大HCl放氧生酸性不活泼金属的含氧酸盐AgNO3阳极水电离的OH-放电,阴极电解质的阳离子放电阴极:Ag++e-===AgAg阳极:O2减小Ag2O【典例1】(河南新乡一中2019届模拟)用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是()A.AgNO3CuCl2Cu(NO3)2B.KClNa2SO4CuSO4C.CaCl2KOHNaNO3D.HClHNO3K2SO4【答案】B【解析】由电解电解质溶液的四种类型可知:类型化学物质pH变化放O2生酸型CuSO4、AgNO3、Cu(NO3)2降低放H2生碱型KCl、CaCl2升高电解电解质型CuCl2HCl升高电解H2O型NaNO3、Na2SO4、K2SO4不变KOH升高HNO3降低【变式1】(江西金溪一中2019届模拟)用石墨作电极,电解稀Na2SO4溶液的装置如图所示,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是()A.逸出气体的体积:A电极<B电极B.一电极逸出无味气体,另一电极逸出刺激性气味气体C.A电极附近呈红色,B电极附近呈蓝色D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶液呈中性【答案】D【解析】SO、OH-移向B电极,在B电极OH-放电,产生O2,B电极附近c(H+)>c(OH-),石蕊溶液变红,Na+、H+移向A电极,在A电极H+放电产生H2,A电极附近c(OH-)>c(H+),石蕊溶液变蓝,C项错误、D项正确;A电极产生的气体体积大于B电极,A项错误;两种气体均为无色无味的气体,B项错误。知识点二电解原理的应用1.氯碱工业阳极反应式:2Cl--2e-===Cl2↑(氧化反应)阴极反应式:2H++2e-===H2↑(还原反应)总反应方程式:2NaCl+2H2O=====2NaOH+H2↑+Cl2↑2.电镀与电解精炼电镀电解精炼铜示意图电极反应阳极Cu-2e-===Cu2+Zn-2e-===Zn2+,Cu-2e-===Cu2+阴极Cu2++2e-===CuCu2++2e-===Cu电解质溶液的浓度变化CuSO4溶液的浓度不变CuSO4溶液的浓度变小3.电冶金电解冶炼冶炼钠冶炼铝电极反应阳极:2Cl--2e-===Cl2↑阴极:2Na++2e-===2Na阳极:6O2--12e-===3O2↑阴极:4Al3++12e-===4Al总反应2NaCl(熔融)=====2Na+Cl2↑2Al2O3(熔融)=====4Al+3O2↑【典例2】(2017·全国卷Ⅱ,11)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶...