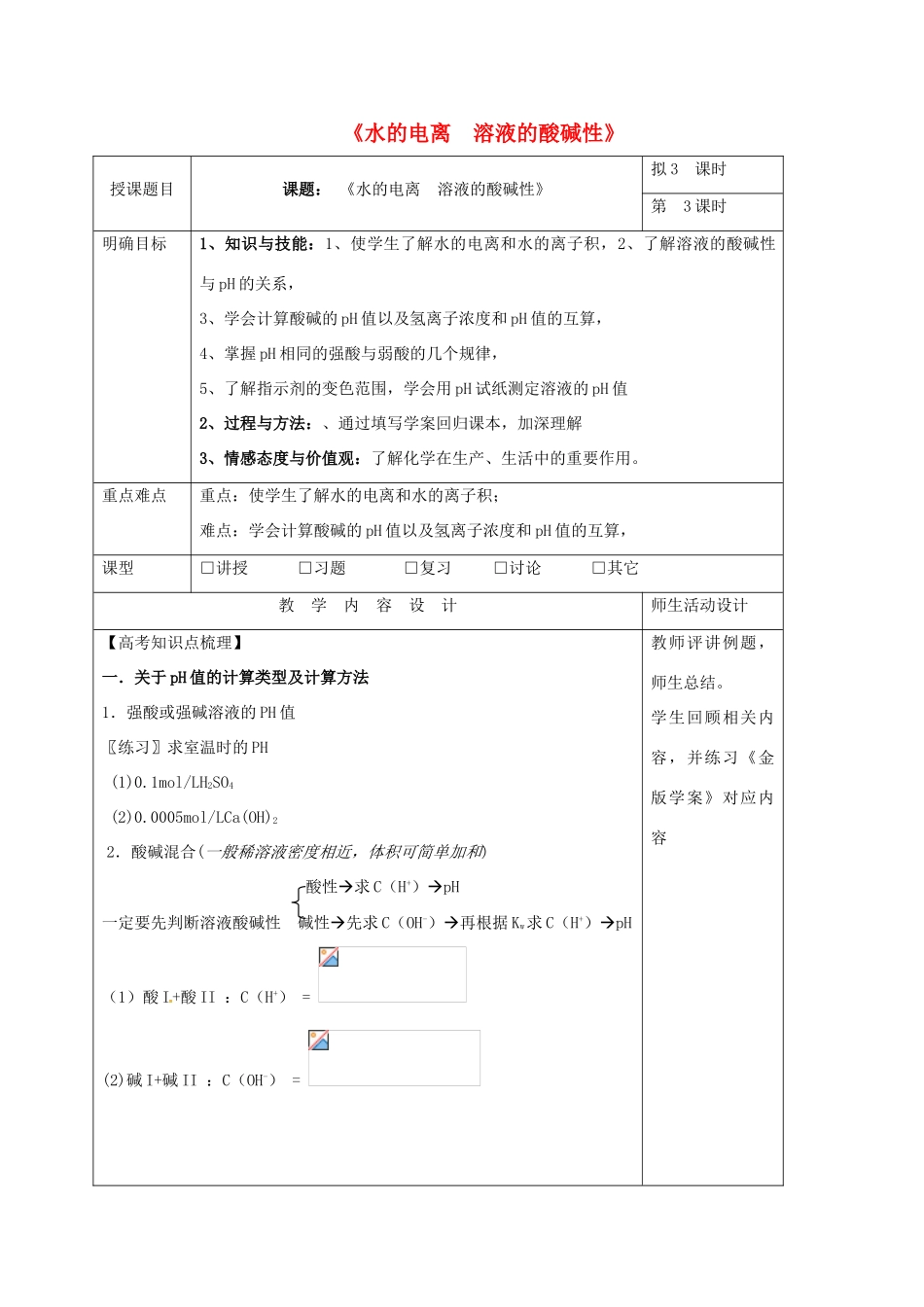
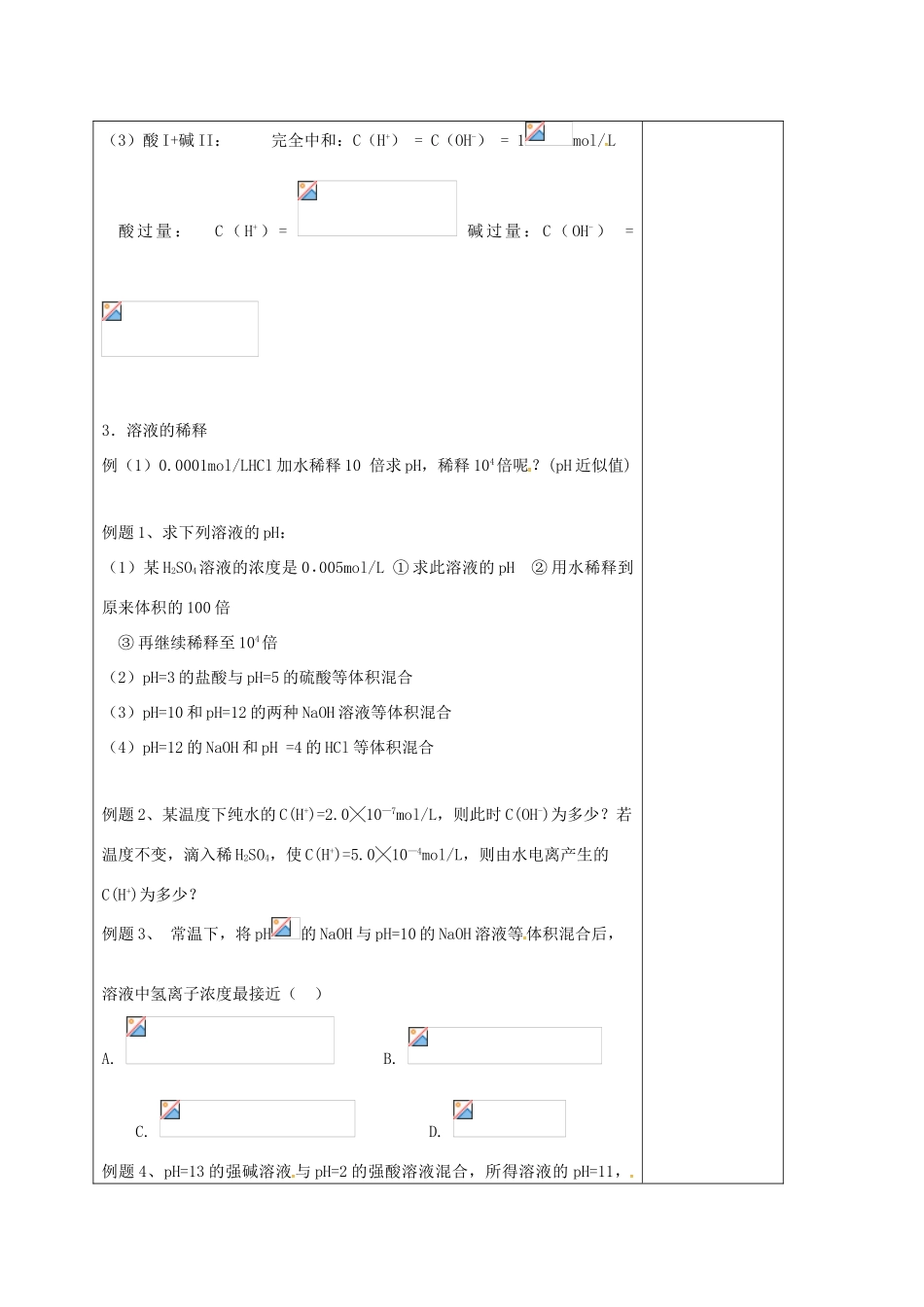
《水的电离溶液的酸碱性》授课题目课题:《水的电离溶液的酸碱性》拟3课时第3课时明确目标1、知识与技能:1、使学生了解水的电离和水的离子积,2、了解溶液的酸碱性与pH的关系,3、学会计算酸碱的pH值以及氢离子浓度和pH值的互算,4、掌握pH相同的强酸与弱酸的几个规律,5、了解指示剂的变色范围,学会用pH试纸测定溶液的pH值2、过程与方法:、通过填写学案回归课本,加深理解3、情感态度与价值观:了解化学在生产、生活中的重要作用。重点难点重点:使学生了解水的电离和水的离子积;难点:学会计算酸碱的pH值以及氢离子浓度和pH值的互算,课型□讲授□习题□复习□讨论□其它教学内容设计师生活动设计【高考知识点梳理】一.关于pH值的计算类型及计算方法1.强酸或强碱溶液的PH值〖练习〗求室温时的PH(1)0.1mol/LH2SO4(2)0.0005mol/LCa(OH)22.酸碱混合(一般稀溶液密度相近,体积可简单加和)酸性求C(H+)pH一定要先判断溶液酸碱性碱性先求C(OH-)再根据Kw求C(H+)pH(1)酸I+酸II:C(H+)=(2)碱I+碱II:C(OH-)=教师评讲例题,师生总结。学生回顾相关内容,并练习《金版学案》对应内容(3)酸I+碱II:完全中和:C(H+)=C(OH-)=1mol/L酸过量:C(H+)=碱过量:C(OH-)=3.溶液的稀释例(1)0.0001mol/LHCl加水稀释10倍求pH,稀释104倍呢?(pH近似值)例题1、求下列溶液的pH:(1)某H2SO4溶液的浓度是0·005mol/L①求此溶液的pH②用水稀释到原来体积的100倍③再继续稀释至104倍(2)pH=3的盐酸与pH=5的硫酸等体积混合(3)pH=10和pH=12的两种NaOH溶液等体积混合(4)pH=12的NaOH和pH=4的HCl等体积混合例题2、某温度下纯水的C(H+)=2.0╳10—7mol/L,则此时C(OH-)为多少?若温度不变,滴入稀H2SO4,使C(H+)=5.0╳10—4mol/L,则由水电离产生的C(H+)为多少?例题3、常温下,将pH的NaOH与pH=10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近()A.B.C.D.例题4、pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比是()A、11:1B、9:1C、1:11D、1:9例题5、常温时某溶液中,测得由水电离出的C(H+)为10-11mol/L,则对此溶液的下列叙述中,正确的是()A、一定是酸溶液B、一定是碱溶液C、可能是pH=3的酸溶液D、可能是pH=11的碱溶液例题6、将pH=5的盐酸溶液稀释1000倍后,溶液的pH为()A、等于8B、等于7C、接近7又小于7D、大于7而小于8例题7、在室温下有pH相等的醋酸和盐酸(pH≤5),请设计实验分别证明它们是哪种酸。【小结】1溶液酸碱性pH计算经验规律(1)两强酸等体积混合混合后的pH=小的+0.3(2)两强碱等体积混合混合后的pH=大的—0.3(3)当按所给反应物质的量之比计算时,酸碱不论强弱,谁大谁过剩,溶液呈谁性。(4)酸碱等体积混合①pH=2某酸与pH=12某碱混合pH难定②pH=4某酸与pH=10NaOH混合pH≤7③pH=4H2SO4与pH=10某碱混合pH≥7④0.01mol/LpH=2一元酸与0.01mol/LpH=12一元碱混合pH=7(5)pH减小一个单位,C(H+)扩大为原来的10倍。PH增大2个单位,C(H+)减为原来的1/100(6)稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)比原来的1/m大,故稀释后弱酸酸性强于强酸。2.关于pH相同的酸(含强酸和弱酸)(1)溶液中c(H+)相等(填“相等”或“不等”)。(2)溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。(3)耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。因材施教:教学后记: